免疫沈降(IP; ImmunoPrecipitation)は抗原と抗体の親和性を利用して、溶液中から抗原を特異的に分離させる方法です。免疫沈降で分離した抗原はSDS-PAGEやウエスタンブロッティングなどの方法で解析します。
原理
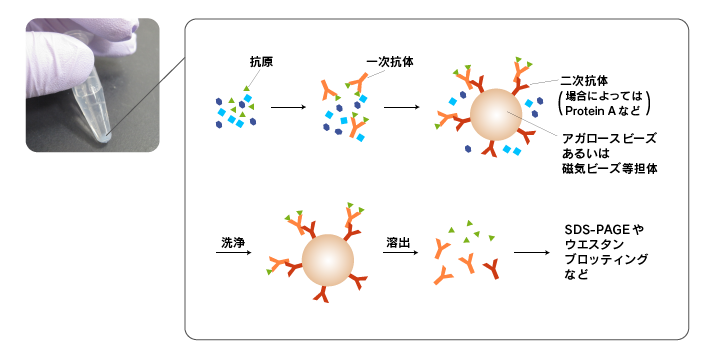
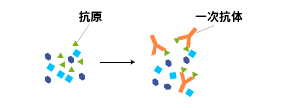
免疫沈降では、まず、抗原を含む溶液に抗体を添加し、溶液中で抗原-抗体複合体を形成させます。
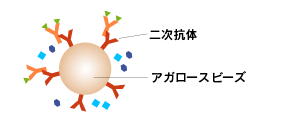
次に、ビーズに固相化したprotein A/Gあるいは一次抗体のグロブリンに対する抗体(二次抗体)を添加し、抗原-抗体複合体をビーズに吸着させます。
最後に、ビーズをよく洗浄した後、酸やSDSを用いてビーズから抗原を溶出します。
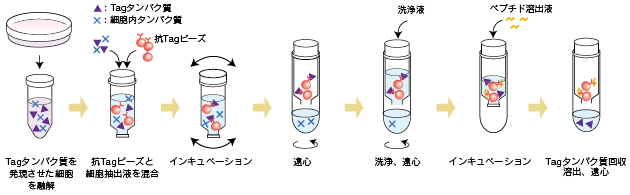
適当な抗体がない場合には、あらかじめ遺伝子組換え操作により目的のタンパク質にエピトープタグをつけ、タグ抗体を用いた免疫沈降を行います(プルダウンアッセイ)。
【関連】タグ融合タンパク質精製キットを用いたプルダウンアッセイ

化学合成されたペプチドや組換えタンパク質を抗原として作製した抗体は、ウエスタンブロッティングでは反応しても、溶液中のネイティブタンパク質とは結合できない場合があります。
市販の抗体を用いる場合は、使用可能なアプリケーションにIPと記載されているものを選ぶことをおすすめします。抗体と抗原、それぞれの性質を製品説明書や文献で把握しておくことも必要です。
効率よく抗原を沈降するために
一次抗体にモノクローナル抗体を用いる場合とポリクローナル抗体を用いる場合で、抗原-抗体複合体の構造は右図のように変わってきます。
 モノクローナル抗体を1次抗体として用いる場合は、
モノクローナル抗体を1次抗体として用いる場合は、
存在量:二次抗体 > 一次抗体 > 抗原
となるようにします。
二次抗体に対して一次抗体が多すぎると、抗原-抗体複合体の一部が(競合的に)二次抗体に結合できなくなり、回収率が低下する恐れがあります。
ポリクローナル抗体を用いる場合は、一次抗体の濃度が高すぎると多分子複合体の形成が阻害されるため、量比を変えて最適条件を探す必要があります。
| モノクローナル抗体 | ポリクローナル抗体 | |
|---|---|---|
| バックグラウンド | 単一の抗原に対する抗体を用いるため、適切に選択すればバックグラウンドは低くなる。 | 特異性の低い抗体分子が含まれている場合には、目的外のタンパク質が混入し、バックグラウンドが高くなる。 |
| 結合力について | 抗体の結合力が低いと溶液中で抗原-抗体複合体が形成されないため、結合力の高いモノクローナル抗体を選ぶ必要がある(解離定数 Kd<10-8 M)。 | 個々の抗体の結合力は低くても、多価で結合するため、多分子の抗原-抗体複合体が形成されやすい。 |
| 抗原-抗体複合体の安定性 | 抗体の結合能力が低い場合、特異性の高いモノクローナル抗体を数種混合させることで、抗体と多価で結合させることができ、安定な抗原-抗体複合体を得られる。 | ポリクローナル抗体と抗原の反応は多価であるため、多分子複合体が形成される。そのため、抗原-抗体複合体は安定である。 |
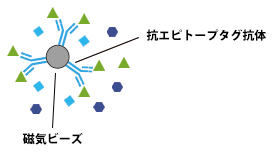
固相化するビーズ
アガロースビーズや磁気ビーズを使用します。
アガロースビーズは網目状構造になっており、ビーズの内部にも抗体を結合させることができます。そのため、目的タンパク質の結合容量も大きくなります。
磁気ビーズは単純な球形であり、操作が簡便で実験時間を短縮できます。ビーズ表面のコーティングが適切であれば、バックグラウンドを低く抑えることができます。反面結合容量が不足する場合もあり、アガロースビーズに比べやや高価です。
磁気アガロースビーズは磁石を用いる簡便な操作性と高い結合容量を持ったビーズです。
| アガロースビーズ | 磁気ビーズ | 磁気アガロースビーズ | |
|---|---|---|---|
| ビーズ径(MBL) |
約100 µm | 約1.6 µm | 約50 µm |
| 模式図 | 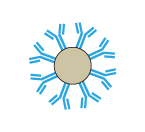 |
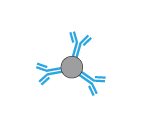 |
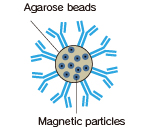 |
| 写真 |  |
 |
 |
| 担体量あたりのIgG結合量 | 多い | やや少ない | 多い |
| サンプルロス | ゲル洗浄の際、サンプルロスが生じる | 磁気で固定できるため、サンプルロスはほとんどない | 磁気で固定できるため、サンプルロスは少ない |
| 遠心操作 | 要 | 不要 | 不要 |
| 磁気ラック | 不要 | 要 | 要 |
| ビーズの見やすさ | 見にくい | 見やすい | 見やすい |
| その他の特徴 | 安価 | 分散しやすく、スクリーニング等に有用 | 磁気ビーズに比べ、安価で収量が多い |
【関連】Smart-IP タグ抗体結合磁気ビーズ・磁気アガロース
界面活性剤
一般的に免疫沈降では、非特異的結合(タンパク質間やタンパク質-ビーズ間)を減らすため、至適濃度の塩と中性界面活性剤を添加します。ただし、界面活性剤を加えることにより、抗体の結合力が弱くなる場合もあるので、特にモノクローナル抗体を使用する場合には予備実験が必要です。
タンパク質分解酵素阻害剤
細胞溶解物や組織抽出物などのサンプル中に含まれるタンパク質分解酵素(プロテアーゼ)により、目的の抗原や、添加した抗体が分解されることがあります。そこで、分解を防ぐためにタンパク質分解酵素阻害剤を加えます。サンプル中に含まれるタンパク質分解酵素の種類が特定あるいは予想できる場合は、それに適した阻害剤を用います。特定できない場合は、PMSFやEDTAなどの低分子阻害剤を複数組み合わせて使用します。
溶出条件
一般には、2-メルカプトエタノール(2-ME)などの還元剤を含むSDSサンプルバッファーで溶出します。溶出液中には、目的タンパク質以外に用いた抗体も含まれます。
ウエスタンブロッティングや質量分析の際にはその点注意が必要です。
方法
ここでは、アガロースビーズを用いる方法とタグ抗体結合磁気ビーズを用いる方法の2種類をご紹介します。
方法1―未標識抗体とアガロースビーズを用いる方法
※MBLでの一例です。
一次抗体反応
 1.5 mLチューブ中で、タンパク質抽出液500 µLに、一次抗体 2~10 µgを加えます。
1.5 mLチューブ中で、タンパク質抽出液500 µLに、一次抗体 2~10 µgを加えます。
4℃で、1時間〜一晩、ローテーターで撹拌し、反応させます。
二次抗体反応
 二次抗体(もしくは protein A/G)結合アガロースビーズを加えます。
二次抗体(もしくは protein A/G)結合アガロースビーズを加えます。
4℃で、1時間〜一晩、ローテーターで撹拌し、反応させます。
洗浄
遠心してアガロースビーズを落とし、ビーズを吸わないように上清を吸引し、除去します。

氷冷した可溶化バッファーもしくは洗浄バッファー 1 mLを加え、撹拌後、遠心して、ビーズを吸わないように上清を除去します。これを3〜4回繰り返します。
★SDS-PAGEやウエスタンブロッティングを行う場合
2-メルカプトエタノール(2-ME)を加えた2xSDSサンプルバッファー 50 µLを加え、5分間加熱し、ビーズから目的タンパク質を抽出します。遠心して、上清をSDS-PAGE用サンプルとして用います。
※抗体も一緒に溶出されるので、その後の解析に注意が必要です。

>>ウエスタンブロッティング(WB)の原理と方法
>>ポリアクリルアミド電気泳動(SDS-PAGE)の原理と方法
★タンパク質の活性や立体構造を保ったまま抽出したい場合(プルダウンアッセイ)
 酸、アルカリなどの過酷な条件下ではなく、中性条件下で溶出用ペプチドを用いて抽出します。
酸、アルカリなどの過酷な条件下ではなく、中性条件下で溶出用ペプチドを用いて抽出します。
【関連】タグ融合タンパク質精製キットを用いたプルダウンアッセイ
方法2―タグ抗体結合磁気ビーズを用いる方法
※MBLでInputサンプルアッセイを行った一例です。
・使用した磁気ビーズ標識タグ抗体:Anti-V5-tag mAb-Magnetic Beads (Code No. M215-11) Lot.003
・Inputサンプル:His-Flag-V5-GFP/293T細胞(1サンプルあたり10 µg/4×106 cell)
Inputサンプルの調製
 サンプルは十分に氷冷しながら扱います。
サンプルは十分に氷冷しながら扱います。
293T細胞(1×107 cell)に50 mM Tris、150 mM NaCl(pH8.0)、1%NP-40を1.2 mL加えてボルテックスします。
その後、12,000 rpmで5分間遠心します。
上清を1 mL回収し、His-Flag-V5-GFP(2.5 mg/mL)を10 µL(=25 µg)加え、Inputサンプルを調製します。
(ここで、SDS-PAGEのInputサンプル用として10 µLを別にとっておきます。)
抗体反応
 Anti-V5-tag mAb-Magnetic Beads(10 mg/mL)を50 µLずつチューブにとり、1 mLのNET-2 bufferで1回洗浄します。
Anti-V5-tag mAb-Magnetic Beads(10 mg/mL)を50 µLずつチューブにとり、1 mLのNET-2 bufferで1回洗浄します。
(磁気ビーズは沈みやすいので使用前にしっかりとボルテックスにかけましょう)
続いて、調製しておいたInputサンプルを400 µLずつMagnetic beadsに加え、4℃で60分間ローテートします。
その後、1 mLのNET-2 bufferで4回洗浄します。(蓋に付いたものも落として洗浄しましょう)
磁気で固定できるため、洗浄時のサンプルロスはほとんどありません。
SDS-PAGE
 1×SDS Sample Bufferを20 µL加えてボルテックスします。
1×SDS Sample Bufferを20 µL加えてボルテックスします。
Inputサンプル10 µLには10 µLのSDS Sample Bufferを加えます。
その後、5分間煮沸して目的タンパク質を抽出します。
↓
SDS-PAGEを行います。20 µL全量をアプライします。
>>ポリアクリルアミド電気泳動(SDS-PAGE)の原理と方法
CBB染色
最後に、CBB染色を行います。
※タンパク量が少ない場合は、CBB染色よりも感度の高い銀染色がおすすめです。
★タンパク質の活性や立体構造を保ったまま抽出したい場合
タンパク質の活性や立体構造を保ったまま抽出したい場合は、磁気ビーズを用いたタグ融合タンパク質精製キットが便利です。
| 免疫沈降(IP)で使用可能な一次抗体 (抗タグ抗体以外) |
モノクローナル一次抗体一覧 ポリクローナル一次抗体一覧 アガロースビーズ結合抗体一覧 磁気ビーズ結合抗体一覧 磁気アガロースビーズ結合抗体一覧 |
| 免疫沈降(IP)で使用可能な抗タグ抗体 | モノクローナル抗タグ抗体一覧 ポリクローナル抗タグ抗体一覧 アガロースビーズ結合抗タグ抗体一覧 磁気ビーズ結合抗タグ抗体一覧 磁気アガロースビーズ結合抗タグ抗体一覧 |
| プルダウンアッセイ関連キット、 ゲル・溶出用ペプチド |
タグ融合タンパク質精製キット一覧 タグ融合タンパク質精製ゲル&溶出用ペプチドセット一覧 |
| その他 | Protein G結合磁気ビーズ 磁気ラック |
| 免疫沈降後の解析に | HRP-DirecTシリーズ  免疫沈降後のウエスタンブロッティングで、抗体由来のバンドが検出されないHRP標識抗体です。目的のタンパク質のバンドがH鎖、L鎖と重なってしまう場合に特におすすめです。実験時間の短縮もできます。 |




