動物に抗原(免疫原)を免疫して抗体を作る方法
動物への免疫を経ないで抗体を得る方法
関連
・ポリクローナル抗体とモノクローナル抗体の違い
・抗体の精製方法
ポリクローナル抗体作製法
作製方法の概要
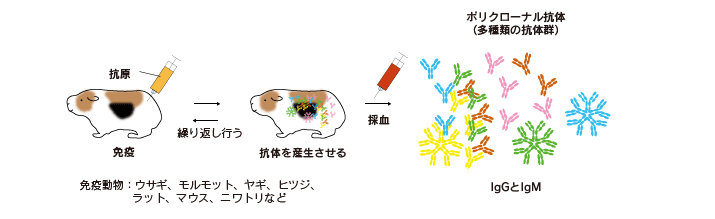
動物に抗原(免疫原)を注射して、血液中に抗体を多量に産生させます。
繰り返し免疫後、数か月してから血液(血漿、血清)を回収し、そこから抗体を精製します(精製方法は後述)。
このとき得られる抗体は免疫原に反応する非常に多くの種類の抗体を含んでいるため、ポリクローナル抗体と呼ばれています。
免疫に使う動物(免疫動物)
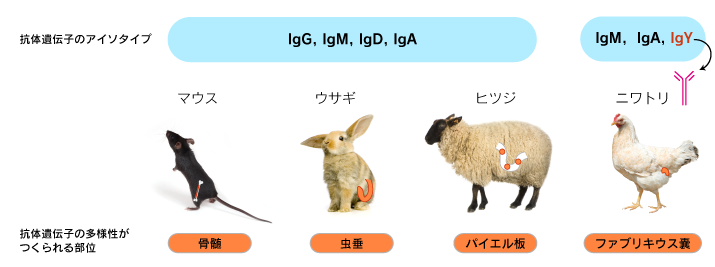
マウス、ウサギの他に、ラット、ハムスター、モルモット、ニワトリ、ヤギ、ヒツジ、ロバなど様々な哺乳動物や鳥類が免疫動物として使用されています。
B細胞の遺伝子の構造や多様性のつくられ方、産生される臓器は、同じ脊椎動物の中でも変化に富んでおり、抗体のアイソタイプも異なります。
抗体のできかた
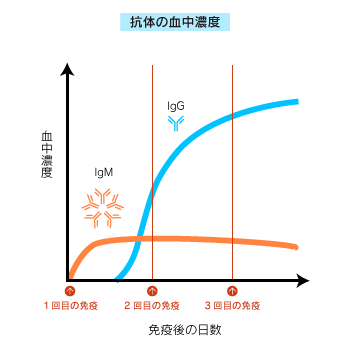 免疫開始すると、まずIgM の血中濃度が上昇します。
免疫開始すると、まずIgM の血中濃度が上昇します。
免疫を続けると、IgG の濃度が上昇します。
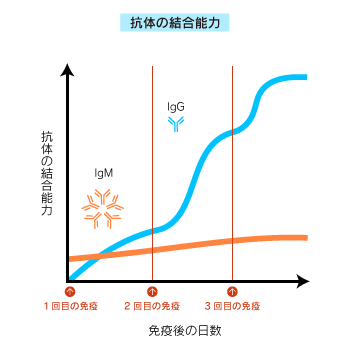 IgMの抗原への親和性(結合能力)は、免疫を続けてもあまり上がりません。
IgMの抗原への親和性(結合能力)は、免疫を続けてもあまり上がりません。
一方、IgGの結合能力は免疫を続けると上昇します。

抗原への親和性が上がるからといって、免疫期間を長くしすぎてもよくありません。免疫期間を長くしすぎると、自己に反応する抗体など非特異反応を示す抗体が増え、また動物も弱ってしまいます。良質な抗体を得るためには、免疫の途中で部分採血を行い、抗原への親和性と非特異反応をチェックすることが大切です。
モノクローナル抗体作製法
作製方法の概要
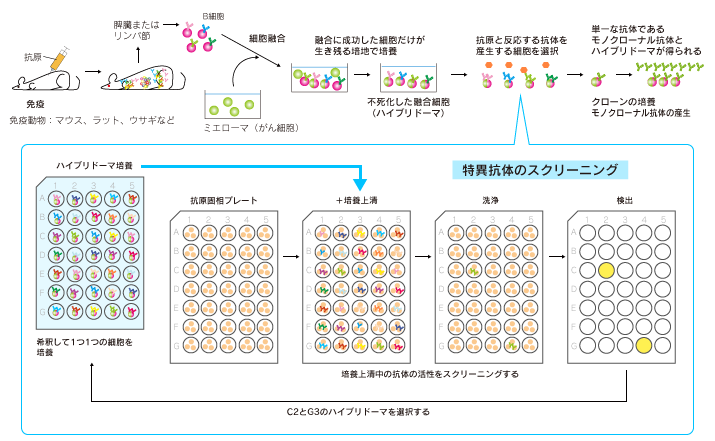

抗体を産生しているB細胞をひとつだけ取り出し、半永久的に培養・増殖させることができれば、単一の抗体(モノクローナル抗体)を安定的に得ることができます。
抗体を産生しているB細胞と不死化したがん細胞(ミエローマ)を人工的に融合させ、特定の抗体遺伝子を維持しながら半永久的に生存できる融合細胞(ハイブリドーマ)を作製します。
このハイブリドーマの中から、結合親和性や特異性に優れた有用なモノクローナル抗体を産生する細胞を選択します。動物に抗原を免疫してから、モノクローナル抗体を得るまでには通常4〜6ヶ月かかります。
モノクローナル抗体におけるクローンの違い
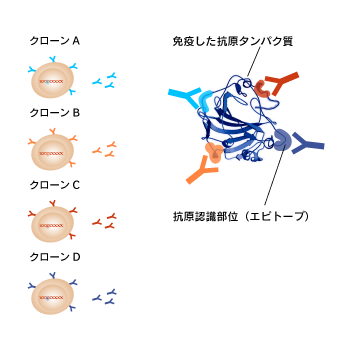 同じ抗原分子に対するモノクローナル抗体でもクローンが異なる場合は、その抗原分子の異なるエピトープ(epitope)を認識します。また、クローンによって適しているアプリケーションも異なります。モノクローナル抗体を選ぶ際には抗原名のみならず、クローン名を見ることが重要です。
同じ抗原分子に対するモノクローナル抗体でもクローンが異なる場合は、その抗原分子の異なるエピトープ(epitope)を認識します。また、クローンによって適しているアプリケーションも異なります。モノクローナル抗体を選ぶ際には抗原名のみならず、クローン名を見ることが重要です。
ファージディスプレイ法
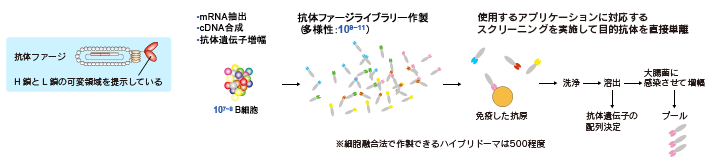

ファージディスプレイ法は、抗体の結合能を決めるH鎖とL鎖の可変領域を短いアミノ酸配列で繋いでファージ上に提示させたライブラリーを用いて、標的分子に対して親和性を有する抗体を選択する技術です。
ファージディスプレイ法に利用される抗体遺伝子の由来は様々です。健常人のB細胞から作製したナイーブ抗体ライブラリーだけでなく、病原体や毒素などに対して高い中和活性を示す抗血清をもつ患者や罹患者由来のB細胞も利用されます。また特定の抗原を免疫された動物のB細胞から作製された抗体ライブラリーも使用されています。
ポリクローナル抗体とモノクローナル抗体の違い
| ポリクローナル抗体 | モノクローナル抗体 | |
|---|---|---|
| 動物種 |
ウサギ(Rabbit)、モルモット(Guinea Pig)、ヤギ(Goat)、ヒツジ(Sheep)、ラット(Rat)、マウス(Mouse)、ニワトリ(Chicken)など | ラット(Rat)、マウス(Mouse)、ニワトリ(Chicken)、ウサギ(Rabbit)、ヒト(Human)など |
| 由来 |
抗血清 | ハイブリドーマ |
| クラス・サブクラス | 複数種類が混在 | 均一 |
| エピトープ | 複数のエピトープに反応 | 単一のエピトープに反応 |
| 特異性 | 複数種の抗体が存在するため、モノクローナル抗体よりは特異性は低い | 良質な抗体を選べば特異性は高い |
| 再現性 | ロット差が生じる | 同一な抗体が半永久的に得られる |
| 安定性 | 複数の抗体が混在しているため、固定などを行った抗原への結合力が失われることが少ない 標識やFc領域の除去などの加工に強い |
全て同じ性質の抗体であるため、固定などを行うと抗原のエピトープが失われ抗体が結合できなくなることがある 標識やFc領域の除去などの加工に弱い |
抗原結合性
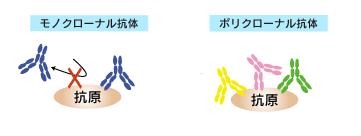 モノクローナル抗体は、抗原1分子に対して1分子以上結合できません。
モノクローナル抗体は、抗原1分子に対して1分子以上結合できません。
一方、ポリクローナル抗体は、抗原1分子に対して多数結合できます(抗原のサイズが十分に大きい場合)。
標識抗体(二次抗体)の場合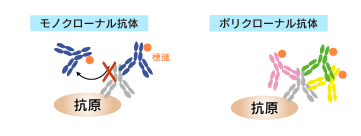
同様に、一次抗体1分子に対して、モノクローナル抗体は1分子しか結合できず、ポリクローナル抗体は多数結合できます。
そのため、二次抗体ではより感度が高い(シグナルが増幅できる)ポリクローナル抗体を用いることが多いです。
タンパク質分解酵素(プロテアーゼ)への感受性
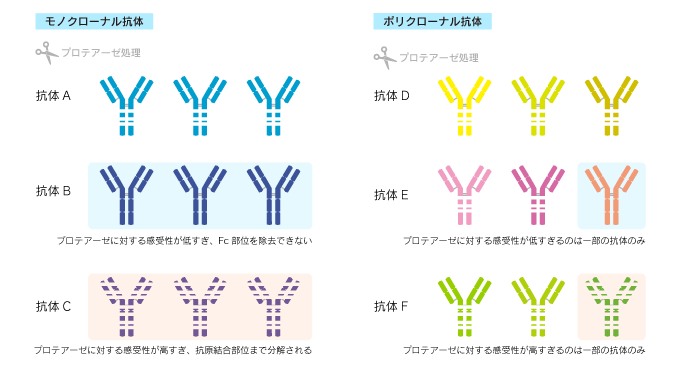
抗体に標識を付加したり、非特異反応の原因となるFc部位を取り除くために、しばしばプロテアーゼによって抗体を加工します。
モノクローナル抗体の場合、例えばプロテアーゼに対する感受性が高すぎると、目的の部位以外も切断される、あるいは抗原への結合能力が失われてしまう場合があります。逆にプロテアーゼに抵抗性がある場合には、想定した加工ができません。
これに対し、ポリクローナル抗体は複数種類の抗体が含まれるため、プロテアーゼに対する感受性の影響を受けにくく、抗原への結合能力が変わりにくいため、加工が上手くいくことが多いです。
抗体の精製方法
抗体の精製は主に以下の3つのステップで行われます。
① 抗体以外のタンパク質・固形物をある程度取り除く
遠心分離・フィルターによる濾過などを行います。
② アフィニティクロマトグラフィーで目的の抗体を取り出す(Protein A/Gを用いた精製、抗原アフィニティ精製)
③ ②の過程で混入した夾雑物を取り除く
ゲルろ過クロマトグラフィーを行い、目的の抗体を高純度に精製し、バッファーを交換します。
Protein A/Gを用いた精製
Protein AまたはProtein Gが固定された粒子が充填されたカラムを用いて、IgGを精製することができます。
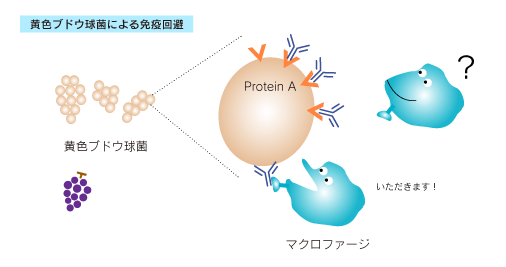 Protein Aは黄色ブドウ球菌の細胞壁タンパク質で、哺乳動物種由来のIgGのFc部位に特異的に結合するタンパク質です。黄色ブドウ球菌はヒトや動物の皮膚、消化管に常在し、時には感染症や食中毒の原因ともなる菌ですが、Protein AによってIgGを捕まえることで、免疫による排除を回避しています。
Protein Aは黄色ブドウ球菌の細胞壁タンパク質で、哺乳動物種由来のIgGのFc部位に特異的に結合するタンパク質です。黄色ブドウ球菌はヒトや動物の皮膚、消化管に常在し、時には感染症や食中毒の原因ともなる菌ですが、Protein AによってIgGを捕まえることで、免疫による排除を回避しています。
※Protein G:連鎖球菌G群の細胞壁から分離されたタンパク質
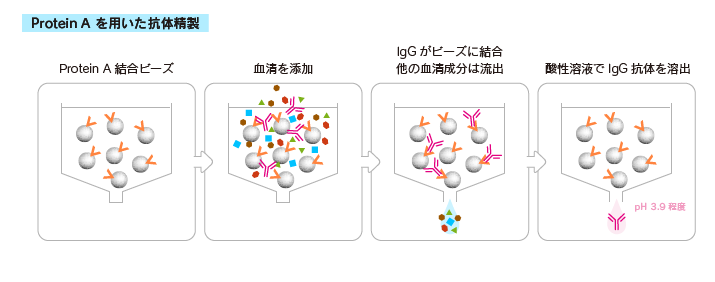
Protein GとProtein Aは、Igへの結合力に動物種やサブクラスにより違いがあるので、目的に応じて使い分ける必要があります。
IgMやIgYの精製では別のカラムを用います。
抗原アフィニティ精製
免疫したものと同じ抗原を固定したカラムで、アフィニティークロマトグラフィーを行い、抗原に結合する抗体だけを精製します。

Protein A/Gのアフィニティクロマトグラフィーより、抗原に結合する特異的抗体の回収率が高い方法ですが、回収できる抗体の絶対量は少なくなります。
また、酸性溶液中で失活する抗体の場合は、Protein A/Gを用いた精製や抗原アフィニティ精製を行うことが不可能であるため、硫安沈殿(塩析)やイオン交換クロマトグラフィーなどで抗体を精製します。
>> 抗体のアイソタイプ・サブクラスの詳細
>> アフィニティークロマトグラフィーの詳細
>> ゲルろ過クロマトグラフィーの詳細



