各部位の名称
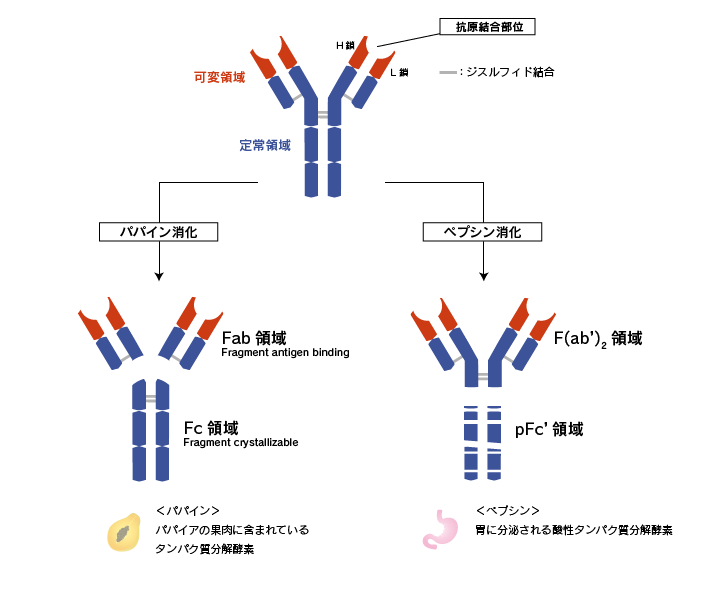
可変領域と定常領域
H鎖とL鎖のN末端側のサブユニットを可変領域(V領域:variable region)と呼び、それ以外の部分を定常領域(C領域:constant region)と呼びます。
抗体によって可変領域のアミノ酸配列は異なります。そのため、可変領域の立体構造は非常に変化に富んでいます。この多様性によって抗体は様々な抗原と結合できるようになっています(抗体の多様性については後述)。
Fab領域とFc領域
抗体をタンパク質分解酵素のパパインで消化すると、H鎖-H鎖を繋ぐジスルフィド結合(ヒンジ部位)の間が切断され、抗体は3 つの断片に分かれます。N末端側の2つの断片をFab領域、C末端側の断片をFc領域といいます。Fabの「ab」は「抗原に結合する(antigen binding)」を指します。一方のFcの「c」は「結晶化できる(crystalizable)」を意味しています。これは、定常領域のアミノ酸配列が抗体間で比較的類似しているため、結晶化できたことに由来します。
F(ab')2領域とpFc'領域
抗体を別のタンパク質分解酵素であるペプシンで消化すると、N末端側にヒンジ部位を含んだ状態で切断されます。これをF(ab')2領域(ファブ ツー プライム)といいます。抗体結合部は、ヒンジ部位を含まないFabと区別するためにFab'(ファブ プライム)といい、それがヒンジ部位で2個結合した状態であることから、F(ab')2と表現します。一方のC末端側のpFc'領域はペプシンによって小さな断片に分解されてしまいます。



