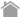蛍光染色と色素染色
| 蛍光色素(低分子蛍光色素) | FITC(Fluorescein Isothiocyanate)、Alexa Fluor®色素、Cy色素 など |
| 蛍光タンパク質 | PE(Phycoerythrin)、APC(Allophycocyanin) など |
■ 色素染色
| 標識酵素 | 発色基質 |
| ペルオキシダーゼ(HRP, POD) | DAB など |
| アルカリフォスファターゼ(ALP, AP) | Fast Red など |
直接法、間接法、増感法
■ 直接法
一次抗体に直接蛍光色素や酵素を標識して使用します。直接標識された一次抗体を用いると実験時間の短縮につながります。
■ 間接法
蛍光物質や酵素を標識した二次抗体を使用して一次抗体を検出します。
■ 増感法
一次抗体をビオチン化し、標識したアビジンで検出します(ビオチン-アビジン複合体)。その他に、増感可能な特殊な二次抗体を販売しているメーカーもあります。
| メリット | デメリット | |
| 直接法 |
|
|
| 間接法 |
|
|
| 増感法 |
|
|
切片の種類
■ パラフィン切片(FFPE切片)… 組織をホルマリンなどで固定し、パラフィンで固めて組織のブロックを作製した後、切片として切り出して染色します。長期保存性に優れており、最もよく用いられる方法です。しかしながら固定・パラフィン包埋に時間がかかることと、その過程で標的タンパク質の構造が変化してしまうため、染色の際は抗原賦活化処理の検討がとても重要になります。
■ 凍結切片 … 凍結した組織を切片として切り出したものです。試料調製の時間が短いため、臨床での術中迅速病理診断に用いられる方法です。また、パラフィン切片に比べて標的タンパク質の構造や酵素活性が保持されているため、抗原賦活化処理が必要ないことも利点です。ただし、長期保存には適していません。
実験の流れ(FFPE切片、間接法)
|
各工程の意義
▌ ベーキングと脱パラフィン
パラフィンは疎水性のため、パラフィンが組織についたままでは抗体が組織に浸透できません。したがってキシレンやエタノールに浸透させて組織からパラフィンを完全に除去する必要があります。キシレンは劇物であるため、最近ではより安全性の高い代替品も販売されています。ベーキング処理は切片に熱を加えてパラフィンを溶かすことで、その後の脱パラフィン処理を行いやすくします。
▌ 抗原賦活化処理
ホルムアルデヒド固定、パラフィン包埋処理の過程で、組織中の抗原が変性し、エピトープが隠れてしまっている可能性があります。そこで、抗体がアクセスしやすいように抗原を露出させることを、抗原賦活化といいます。抗原賦活化処理には大きく2つあり、熱処理と酵素処理があります。熱処理はpH6.0 クエン酸バッファー、もしくはpH9.0 Tris-EDTAバッファーを用いるのが一般的です。熱処理の方法はオートクレーブ、電子レンジ、圧力鍋、ウォーターバスなど様々あります。一方、酵素処理とはProteinase Kやペプシンを反応させる方法です。熱処理よりも組織形態が崩れやすい傾向にあるため、注意が必要です。最適化のためには使用する抗体によりその方法、pH、温度、時間を検討する必要があります。
▌ 内在性POD不活性化処理
HRP(POD)の酵素活性を用いた染色を行う際には、組織に含まれる内在性ペルオキシダーゼを除去する必要があります。3%過酸化水素水/ PBSを10分程度反応させる方法が一般的です。反応時間の不足、失活した過酸化水素の使用によって内在性PODの不活性化が十分に行われないと、組織中のペルオキシダーゼと基質であるDABが反応してしまい、非特異染色の原因になります。
▌ 対比染色
目的タンパク質の染色とは対照的な色の染色を行い、組織・細胞内の特定の構造物を可視化するために行います。一般的にヘマトキシリン(青~紫)やメチルグリーン(緑)が核染色に用いられます。ヘマトキシリンで染色した際は流水やアルカリ性水溶液を用いた色だし処理が必要となります。方法や温度で色味が異なるため、注意が必要です。
▌ 脱水・透徹
疎水性封入剤を用いる場合、これまでの過程で組織に含まれた水分を除去する必要があります。親水性のあるエタノールで脱水を行った後、キシレンにより完全に組織内の水分を除去します(透徹)。水溶性封入剤を用いる場合はこの過程は必要ありません。
▌ 封入
封入処理は、サンプルの乾燥・退色を防ぎ、長期保存するために必要な作業です。封入剤には水溶性と非水溶性(疎水性)の2種類があります。疎水性封入剤はキシレンベースのものが一般的に用いられています。染色スライドを長期間保管したい場合には、疎水性封入剤を選択します。
準備が必要なもの(FFPE切片の場合)
・オートクレーブ、あるいは電子レンジなど(抗原賦活化用)
・染色バット
・湿潤箱
・撥水ペン(パップペン)
・組織FFPE切片
・キシレン(あるいは脱パラフィン用試薬)
・エタノール
・蒸留水
・抗原賦活化用バッファー(pH6.0クエン酸バッファー、pH9.0 Tris-EDTAバッファーなど)
・ブロッキング剤(BSA、血清など)
・PBS
・0.05~0.2% Tween20/PBS (PBS-T)
・一次抗体
・酵素(蛍光)標識二次抗体
・DABなどの発色基質
・封入剤
方法
1. はじめに
 インキュベーターを60°Cに設定し、パラフィンを溶かし落とすようにスライドを斜めに置きます。約2時間静置。
インキュベーターを60°Cに設定し、パラフィンを溶かし落とすようにスライドを斜めに置きます。約2時間静置。
2. 脱パラフィン
キシレンに5分×3回浸透。続けて無水エタノール 5分×1回⇒99.5%エタノール 5分×1回⇒90%エタノール 5分×1回⇒70%エタノール 5分×1回浸透します。※キシレンへの浸透を3回行ってもパラフィンが残っている場合、キシレンを新しいものと入れ替え、再度浸透します。
蒸留水で3分×1回、PBSで 2分×3回洗浄します。
※動画は浸漬時間を削除編集しております。
3. 抗原賦活化
 10 mM クエン酸バッファー(10 mM クエン酸緩衝液 (pH 6.0), 0.05% Tween-20)もしくはTrisバッファー(10 mM Tris塩酸緩衝液 (pH 9.0), 0.05% Tween-20、1 mM EDTA)をビーカーに入れ、125℃で5分間オートクレーブにかけます。
10 mM クエン酸バッファー(10 mM クエン酸緩衝液 (pH 6.0), 0.05% Tween-20)もしくはTrisバッファー(10 mM Tris塩酸緩衝液 (pH 9.0), 0.05% Tween-20、1 mM EDTA)をビーカーに入れ、125℃で5分間オートクレーブにかけます。
オートクレーブが85℃まで下がった段階でビーカーを取り出し、室温まで冷まします。
 もしくは、電子レンジ(10分間×2回程度)を使用して賦活化します。
もしくは、電子レンジ(10分間×2回程度)を使用して賦活化します。
冷めたらPBSで洗浄し、3% 過酸化水素/PBSを染色バットに入れ、室温で10分インキュベートします。
4. ブロッキング
 PBS で5分×3回洗浄したのち、組織切片部をパップペンで囲みます。パップペンで組織の周りを囲むことで、撥水性の枠を作ることができます。
PBS で5分×3回洗浄したのち、組織切片部をパップペンで囲みます。パップペンで組織の周りを囲むことで、撥水性の枠を作ることができます。
※必須ではありませんが、試薬の節約や均一に反応させるために有効です。この枠はキシレンにより除去することができます。
ブロッキング液 (0.5%BSA, 5%ヤギ血清/PBS(二次抗体がヤギ由来の場合))を500 µL載せ、室温で30分静置します。
5. 一次抗体反応
 ブロッキング液を除き、ブロッキング液で希釈した一次抗体(例:1 µg/mL)をスライドに500 µL載せ、室温で1時間静置します。
ブロッキング液を除き、ブロッキング液で希釈した一次抗体(例:1 µg/mL)をスライドに500 µL載せ、室温で1時間静置します。
※乾燥を避けるため、湿潤箱などに入れて反応させます。
その後、PBS-T (0.05% Tween-20/PBS) 5分×3回洗浄し、PBS 5分×1回すすぎます。

6. 二次抗体反応・発色
 Histostar™ (Ms + Rb) for Human tissue (Code No. 8460) を適量滴下し(5~7滴)、室温で1時間静置します。
Histostar™ (Ms + Rb) for Human tissue (Code No. 8460) を適量滴下し(5~7滴)、室温で1時間静置します。
PBS-T (0.05% Tween-20/PBS) 5分×3回洗浄し、PBS 5分×1回すすぎます。
Histostar™ DAB Substrate Solution (Code No. 8469) を適量滴下し、様子を見ながら室温で3分~最長10分発色反応を行います。
※動画は反応時間を早送り編集しております。
7. 対比染色
 蒸留水で洗浄します。
蒸留水で洗浄します。
マイヤーヘマトキシリンを500 µL載せ(あるいはヘマトキリシンを入れた染色バットに入れ)、5分静置します。
組織に直接水が触れないように流水で20分洗浄し、色だしを行います。
8. 脱水・透徹・封入
 80%, 95%, 99.5%, 無水エタノールに順番に浸したのち、キシレンに2回浸透させます。
80%, 95%, 99.5%, 無水エタノールに順番に浸したのち、キシレンに2回浸透させます。
キシレンベースの疎水性封入剤で封入し、乾燥させます。