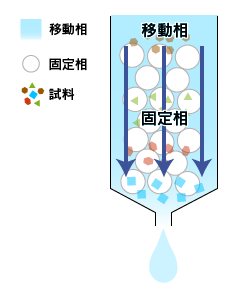
物質間の相互作用を利用して物質を分離する方法です。
原理と方法
固定相または担体と呼ばれる物質の表面あるいは内部を、移動相と呼ばれる溶媒が通り抜ける過程で、固定相の物質と移動相内の物質(溶質)の間で相互作用が生じます。相互作用を利用して、異なる性質の溶質を分離します。
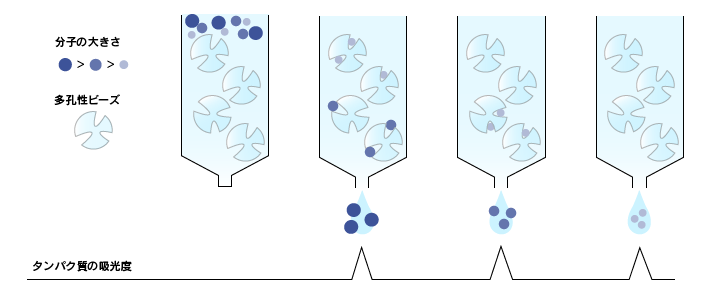
ゲルろ過クロマトグラフィー
分子量の違いによってタンパク質を分離する方法で、分子篩(ぶんしふるい)と呼ばれていたこともあります。
試料を小さな孔の開いている担体を詰めた管(カラム)の上部に加えて流すと、分子量の小さいタンパク質はその孔に入り込みながら流れ、大きなタンパク質は孔に入らずにそのまま流れ落ちます。そのため、カラムを通過する時間が小さいタンパク質は遅く、大きいタンパク質は早くなりますので、結果的にタンパク質が大きさで分離されます。
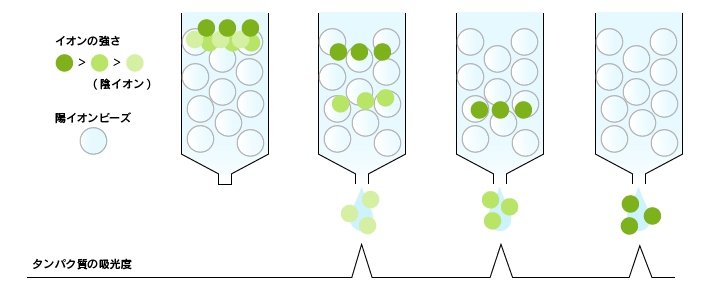
イオン交換クロマトグラフィー
電気的な性質(電荷)でタンパク質を分ける方法です。
タンパク質は全体として電荷をもっています。この特徴を利用し、正電荷を示す塩基性タンパク質は負電荷をもつ担体(陽イオン交換体)に、一方、負電荷を示す酸性タ ンパク質は正電荷を持つ担体(陰イオン交換体)に結合します。これはイオン結合によるものです。試料をイオン交換体を詰めたカラムに結合させた後、溶媒の塩濃度を高くしていくと、イオン結合 が弱くなっていきますので、結合力の弱いタンパク質から順に外れて流れ出てきます。このように、タンパク質が電荷によって分離されます。
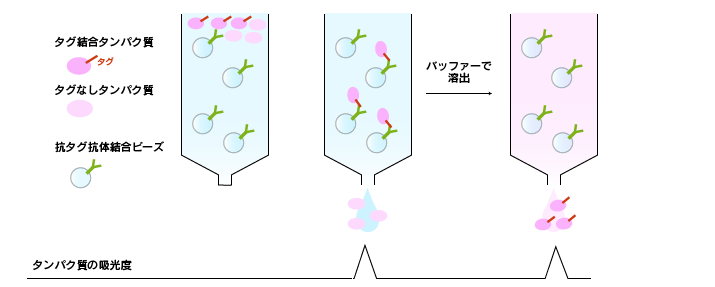
アフィニティークロマトグラフィー
結合親和性でタンパク質を分ける方法です。
酵素、受容体、抗体などのタンパク質は特定の物質(リガンド)に強い結合親和性を有しています。担体にリガンドを固定してカラムを作製し、そこにタンパク質溶液を添加すると、リガンドと結合するタンパク質だけがカラムに保持されます。ここにリガンド(あるいはその類似物質)を含む溶液を添加すれば、競合的に目的タンパク質のみ分離することができます。
汎用されている例として、遺伝子組み換えタンパク質を発現させる際にエピトープタグと呼ばれる特徴的なペプチド配列を付加する場合があります。エピトープタグに特異的に結合する抗体を担体に結合させたものを用いてアフィニティークロマトグラフィーを実施すると、目的の遺伝子組換えタンパク質を容易に高純度に精製することができます。エピトープタグの代わりとして蛍光タンパク質、糖結合タンパク質、金属結合タンパク質などを目的タンパク質と融合させる場合もあります。