抗原特異的T細胞の誘導方法
- ▶ ヒト末梢血を用いた細胞傷害性T細胞(CTL)の誘導[MLPC法(modified by MBL)]
- ▶ 応用例:がん抗原WT1(変異型)特異的CTLの誘導と検出
- ▶ 抗原特異的マウスCTLの誘導方法
ヒト末梢血を用いた細胞傷害性T細胞の誘導[MLPC法(modified by MBL)]
T-Select MHC Tetramerは、ウィルス抗原特異的、あるいはがん抗原特異的CTLの検出用試薬として用いられています。しかしながら、ウィルス抗原と異なり、がん抗原特異的CTLの数は非常に少なく、採血直後に検出することが非常に難しい場合が多いと考えられます。そこで、短期間のペプチド刺激培養後に、がん抗原特異的CTLの血中頻度を算出する方法として考案されたのが96-well plateを利用したMLPC法(Mixed Lymphocyte-Peptide Cultures)です。メラノーマ患者に対するワクチン療法の結果、患者末梢血中の特異的CTL数が増加することをMLPC法で確認したKaraniksらの論文(J. Immunol, 2003, 171:4898)を参考に、MBLにて方法を改良し、より簡便に、より経済的に、健常人末梢血からがん抗原特異的CTLを誘導する方法を考案しました。
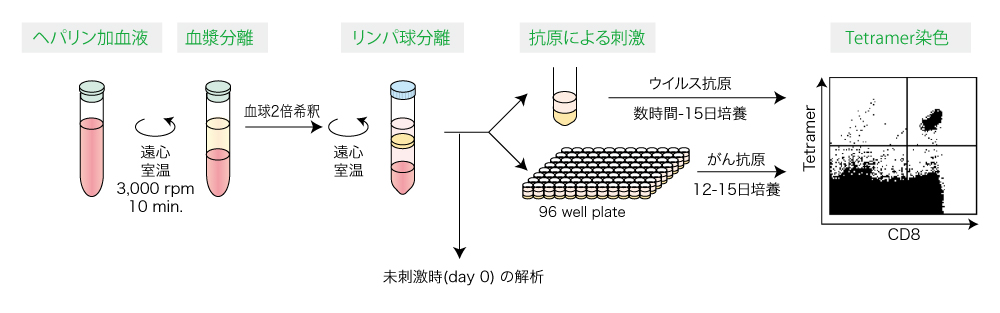
- 【採血】
- ヘパリンナトリウム以外の抗凝固剤の使用は避けてください。採血後は、採血管をよく倒立攪拌してください。
直ちに処理できない場合は、室温にて静置してください。 - 【血漿分離】
- 分離した血漿は、再度低速遠心後、小分けして−30℃に保存し、凍結融解を繰り返さないようにしてください。
- 【培養条件】
- 「培養medium: 5% autoplasma/50 U/mL IL-2/2-ME/antibiotics/RPMI1640」
抗原ペプチドを10 μg/mL加えて、96-well U-bottom plateにマルチピペッターを用いて100 μL/wellでまき込みます。48時間後にIL-2入りのmediumを100 μL/wellずつ加えます。その後はmediumの色を目安に最初の1週間は1回程度、次の1週間は2~3日毎にmediumを半量ずつ交換します。加えるペプチドとIL-2の濃度は至適化されていません。ペプチド濃度はペプチドの溶解度やBIMAS等のスコアを参考に、至適条件の検討が必要です。 - 【抗原刺激】
- ウィルス抗原特異的CTLを誘導する際は、チューブを用いてのMLPC法で可能な場合が多いですが、がん抗原特異的CTLを誘導する際は、その存在頻度が低いため、次に示す96-well plateを利用したMLPC法をお勧めします。
がん抗原WT1(変異型)特異的CTLの誘導と検出
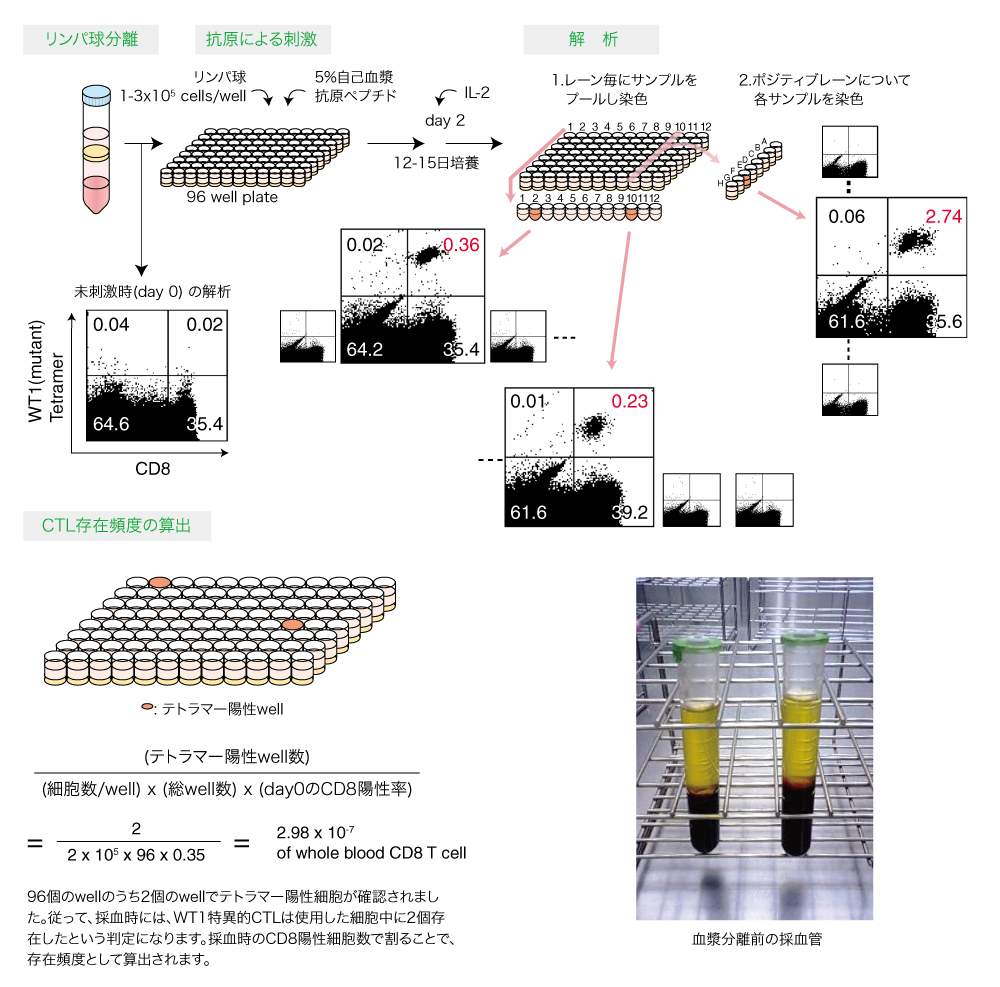
がん抗原WT1を例にして、96-well MLPC法の手順を以下に示しました。HLA-A*24:02陽性健常人末梢血よりPBMCを分離し、96-well MLPC法にてWT1(mutant)特異的CTLを誘導しました。ペプチド刺激後、14日目にT-Select WT1(mutant)Tetramer(Code No. TS-M014-1)で染色を行いました。まず96-well plateの1つのレーン毎にサンプルをプール(8 well分)し、12プールをそれぞれ染色しました。次に、テトラマー陽性細胞が検出されたレーンから1wellずつサンプリングを行い、テトラマー試薬で染色して特異的CTLの存在しているwellを同定しました。これらの陽性well数より、以下の計算式を用いて、特異的CTLの採血時における存在頻度を算出しました。

抗原特異的マウスCTLの誘導方法
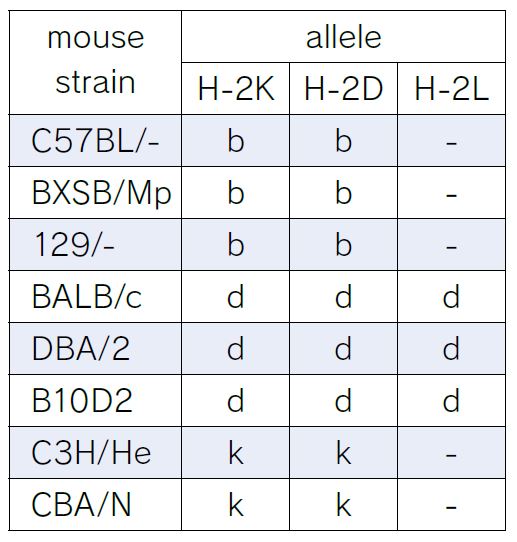 マウスモデルは感染実験、ワクチンの開発、免疫療法の検討など、生体内のさまざまな免疫応答の観察に使用されています。
マウスモデルは感染実験、ワクチンの開発、免疫療法の検討など、生体内のさまざまな免疫応答の観察に使用されています。
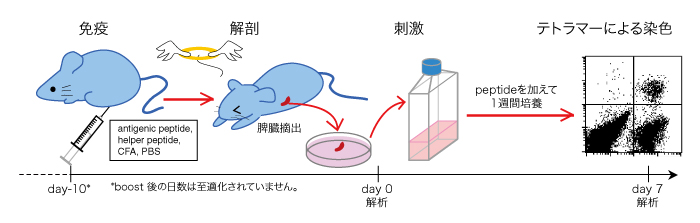
T-Select Mouse MHC Tetramerは、マウスの抗原特異的CTLを検出することができます。MBL社内検討の結果、次の方法で、より早く、安価で簡単に抗原特異的CTLを誘導可能であることが分かりました。まず、目的の抗原ペプチドとヘルパー作用の報告がある抗原ペプチドを混合し、免疫賦活剤とエマルジョン化して腹腔免疫します。最後の免疫から7-11日後に脾臓を摘出します。脾細胞はフラスコ内でペプチド刺激して1週間培養します。下図にタイムスケジュールを示します。免疫回数は抗原によって違いますが、社内検討では、1-4回で抗原特異的CTLを誘導することができました。個体差がありますので、1抗原に対して2匹以上のマウスを用いることをお勧めします。詳細は、各テトラマー製品のデータシートをご覧ください。
 OVAテトラマーを用いた細胞染色時の、CTL誘導方法の詳細なプロトコールもございます。
OVAテトラマーを用いた細胞染色時の、CTL誘導方法の詳細なプロトコールもございます。
お問い合わせからご要望ください。
テクニカルヒント
・検出原理・作製方法・特徴
・細胞染色プロトコール
・CD8抗体クローンによる染色性の違い
・抗原特異的T細胞の誘導方法
・FAQ
・製品使用例
・トラブルシューティング



