MHCテトラマー細胞染色プロトコール
ヒト全血の場合
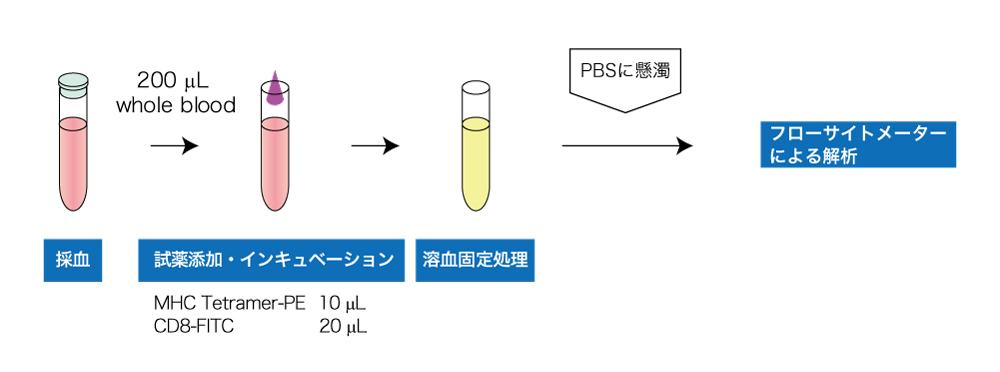
- 1)
- ヘパリン採血管にて静脈血を採取します。
- 2)
- 200 μLの全血に10 μLのT-Select MHC Tetramer-PEを加えます。
- 3)
- ゆっくりとボルテックスをかけます。
- 4)
- 遮光し、室温 (15~25℃)または2~8℃で30~60分間インキュべーションします。
- 5)
- CD8抗体等を加え、遮光して2~8℃で30分間インキュべーションします。
- 6)
- OptiLyse C(Beckman Coulter 社製分析機器用)、もしくはOptiLyse B(BD Biosciences社製分析機器用)を用いて溶血・固定処理します。各々の説明書にて推奨の手順に従ってください。
- 7)
- 溶血・固定プロトコールの最終ステップ後、適量のPBS を加えて再懸濁します。
- 8)
- 400 x gで5分間遠心します。
- 9)
- 上清を注意深く捨て、細胞を500 μLのPBSに再懸濁します。
*すぐに測定しない場合、サンプルは0.5%パラフォルムアルデヒド/PBSに懸濁して暗室にて4℃で保管し、24時間以内に分析してください。
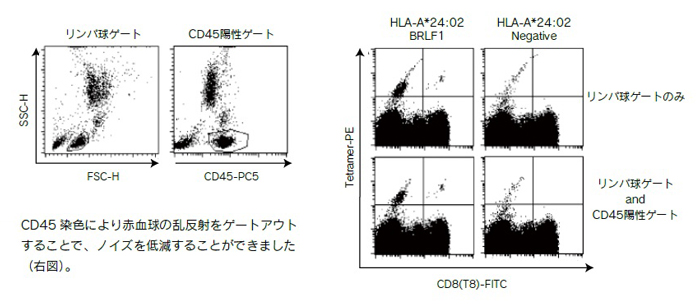
★ 溶血処理が不十分な場合、赤血球の乱反射による非特異的染色像が観察されることがあります。CD45を同時染色してリンパ球ゲートで解析してください。
ヒトPBMCの場合
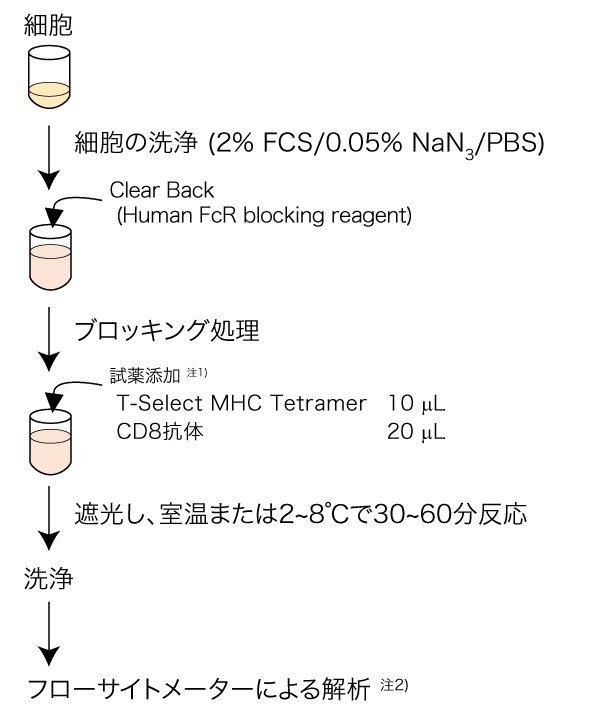
- 1)
- 定法に従って細胞を調製し、1×106-7 cells/mLの濃度にて、細胞を再懸濁します。
- 2)
- 50 μLの細胞懸濁液に10 μLのClear Back(Code No. MTG-001)を加え、室温にて5分間反応させてください。
- 3)
- 10 μLのT-Select MHC Tetramerを加えます。
- 4)
- 遮光し、室温 (15~25℃)または2~8℃で30~60分間インキュべーションします。
- 5)
- CD8抗体等を加え、遮光して2~8℃で30分間インキュべーションします。
- 6)
- 適量のFCM buffer [2% FCS/0.05% NaN3/PBS] を加え400 x gで5分間遠心します。
- 7)
- 上清を注意深く捨てます。
- 8)
- 細胞を500 μLのFCM bufferに再懸濁します。
* すぐに測定しない場合、サンプルは0.5%パラフォルムアルデヒド/PBSに懸濁して暗室にて4℃で保管し、24時間以内に分析してください。
注1)
- ・
- Human CD8抗体は、クローンHit8a (Code No. K0226-4)、SFCI21Thy2D3(通称T8)あるいはMCD8のご使用を強く推奨します。他クローンの場合、TCRとテトラマー試薬の結合を阻害または増長する可能性があります。詳しくは「CD8抗体クローンによる染色性の違い」をご確認ください。
- ・
- 先にテトラマー試薬で染色後、続けてCD8抗体で染色を行うと、染色性が良くなることがあります。
- ・
- ご使用になるテトラマー試薬の特異性を判断するために、Negative Control Tetramerと、可能ならばPositive Control Tetramerを同時に染色することをお勧めします。
注2)
- ・
- 培養した場合は、7-AAD Viability Dye(死細胞検出試薬)を加え、FSC/FL3のドットプロット展開より、死細胞を除去して解析してください。
マウス全血の場合
- 1)
- 定法に従い、適切な抗凝固剤を使用して静脈血を採取します。
- 2)
- 12 x 75 mmのテストチューブに10 μLのT-Select MHC Tetramerを加えます。
- 3)
- 全血100 μLを加え、ゆっくりとボルテックスをかけます。
- 4)
- 遮光し、室温あるいは2-8°Cで30-60分間インキュベーションします。
- 5)
- CD8抗体等を加えゆっくりとボルテックスをかけます。
- 6)
- 遮光し、2-8°Cで30分間インキュベーションします。
- 7)
- 市販の試薬などで赤血球の溶血処理を行ってください。
- 8)
- 400 x gで5分間遠心します。
- 9)
- 上清を注意深く捨て、細胞を500 μLのPBSに再懸濁します。
* すぐに測定しない場合、サンプルは0.5%パラフォルムアルデヒド/PBSに懸濁して暗室にて4℃で保管し、24時間以内に分析してください。
マウス脾臓細胞の場合
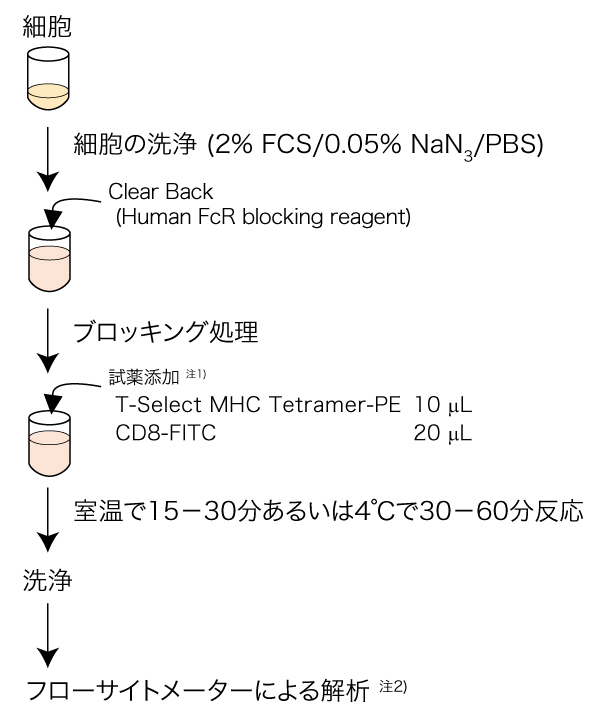
- 1)
- 定法に従って細胞を調製し、1×106-7 cells/mLの濃度にて、細胞を再懸濁します。
- 2)
- 50 μLの細胞懸濁液に10 μLのClear Back(Code No. MTG-001)を加え、室温にて5分間反応させてください。
- 3)
- 10 μLのT-Select MHC Tetramer-PEを加えます。
- 4)
- 室温で20分間、あるいは4℃で30分間インキュべーションします。
- 5)
- CD8抗体等を加え、遮光して2~8℃で30分間インキュべーションします。
- 6)
- 適量のFCM buffer [2% FCS/0.05% NaN3/PBS] を加え400 x gで5分間遠心します。
- 7)
- 上清を注意深く捨てます。
- 8)
- 細胞を500 μLのFCM bufferに再懸濁します。
*すぐに測定しない場合、サンプルは0.5%パラフォルムアルデヒド/PBSに懸濁して暗室にて4℃で保管し、24 時間以内に分析してください。
注1)
- ・
- Mouse CD8抗体は、クローンKT15(Code No. K0227-4)のご使用を強く推奨します。
他クローンの場合、TCRとテトラマー試薬の結合を阻害または増長する可能性があります。 - ・
- 先にテトラマー試薬で染色後、続けてCD8抗体で染色を行うと、染色性が良くなることがあります。
- ・
- ご使用になるテトラマー試薬の特異性を判断するために、Negative Control Tetramerと、可能ならばPositive Control Tetramerを同時に染色することをお勧めします。
注2)
- ・
- 培養した場合は、7-AAD Viability Dye(死細胞検出試薬)を加え、FSC/FL3のドットプロット展開より、死細胞を除去して解析してください。
テクニカルヒント
・検出原理・作製方法・特徴
・細胞染色プロトコール
・CD8抗体クローンによる染色性の違い
・抗原特異的T細胞の誘導方法
・FAQ
・製品使用例
・トラブルシューティング



