QuickSwitch™ カスタム テトラマーキットを用いた
ネオアンチゲン反応性T細胞の解析

|
 |

|
 |
|||||||
| 小林 由香利 先生 | 細井 亮宏 先生 | 木村 真之介 先生 | 垣見 和宏 先生 | |||||||
| 東京大学医学部附属病院 免疫細胞治療学講座 | ||||||||||
ネオアンチゲン
抗PD-1/PD-L1抗体などの免疫チェックポイント阻害剤の登場により、がん免疫治療が注目されている。免疫チェックポイント阻害剤の作用機序は、腫瘍内で抑制されていた内在性の抗腫瘍免疫の再活性化であり、その中心を担うのが、腫瘍特異的T細胞である1)。免疫チェックポイント阻害剤によって再活性化された腫瘍特異的T細胞が認識するがん抗原は、がん細胞の遺伝子変異産物に由来するネオアンチゲンであることが明らかになったことから、腫瘍特異的T細胞とネオアンチゲンの研究に高い関心が寄せられている2)。
細胞内のタンパク質は、9~11アミノ酸からなるペプチドに分解された後、MHCクラスI分子のポケット状の構造に結合して細胞表面に提示されている3)。このペプチド/MHC複合体がT細胞受容体(TCR)によって認識される。通常、T細胞は胸腺でのネガティブセレクションで免疫寛容が誘導されることで自己免疫反応が抑制されるため、正常細胞に発現するタンパク質に対しては免疫反応が起こらない。一方、がん細胞はそのがん化の過程で多くの体細胞遺伝子突然変異(somatic mutation)を蓄積しており、正常細胞に存在しないアミノ酸変異を伴うタンパク質を発現している。そのような変異を含んだタンパク質は、もともと体内に存在しない抗原であることから“ネオ”アンチゲンと呼ばれている。このネオアンチゲンには、胸腺での免疫寛容の誘導がないため、強いT細胞免疫応答が期待できる(免疫原性が高い)。また、変異アミノ酸を含み、MHCクラスI分子に結合してT細胞に認識されるペプチドをネオエピトープと呼ぶ(図1)4)。
図1. 腫瘍特異的遺伝子変異産物に由来するネオアンチゲン
次世代シーケンサーを用いたネオアンチゲンの予測
 がん細胞に認められる遺伝子変異には、がん化や細胞増殖に直接関わるドライバー変異と、それに関係がないと思われるパッセンジャー変異が含まれる。分子標的薬の開発のためには、ドライバー変異の同定が重要であるが、腫瘍免疫の標的抗原分子としては、ドライバー変異もパッセンジャー変異も区別なくアミノ酸変異を伴えばネオアンチゲンとなり得る。しかしながら、ある一定の割合で複数の患者において共通に認められるドライバー変異と異なり、多くのパッセンジャー変異は個々の患者に固有の変異であるため、これまで薬剤の開発の対象とならなかった。
がん細胞に認められる遺伝子変異には、がん化や細胞増殖に直接関わるドライバー変異と、それに関係がないと思われるパッセンジャー変異が含まれる。分子標的薬の開発のためには、ドライバー変異の同定が重要であるが、腫瘍免疫の標的抗原分子としては、ドライバー変異もパッセンジャー変異も区別なくアミノ酸変異を伴えばネオアンチゲンとなり得る。しかしながら、ある一定の割合で複数の患者において共通に認められるドライバー変異と異なり、多くのパッセンジャー変異は個々の患者に固有の変異であるため、これまで薬剤の開発の対象とならなかった。
次世代シーケンサー(NGS)の登場によって個人レベルでのゲノムが解読可能となったことから、手術や生検で得られた患者毎の組織からDNAとRNAを抽出して、エクソームとトランスクリプトームを解析し、それをもとにネオアンチゲンの予測が可能になった5)。ネオアンチゲンの同定アルゴリズムは、決して特別なものではない。これまでの分子生物学、免疫学の知見に基づき、分子標的薬の標的分子となるドライバー変異を同定するパイプラインと、ペプチドがんワクチンの開発パイプラインを組み合わせてネオアンチゲン/ネオエピトープの予測アルゴリズムが構成されている6)。アミノ酸変異を伴う遺伝子変異産物のうち、患者の持つMHCと結合能が高いと期待される9~11アミノ酸配列からなるペプチドがネオエピトープの候補としてリストアップされる。
ネオアンチゲン反応性T細胞のスクリーニング
現状では、ネオアンチゲンの予測はあくまでも予測に過ぎず、実際に患者の体内に変異ペプチドに反応するリンパ球が存在するか否か?存在してもそれが腫瘍特異的免疫応答にどの程度貢献しているか?また、それを治療にどのように結びつけることが可能か、に関して多くの解決すべき課題が残されている。食道がん患者のNGSデータから得られたネオエピトープのリストから、実際に患者の末梢血単核球(PBMC)が反応したネオエピトープペプチドを同定した1例を紹介する。
食道がん患者の全エクソンシーケンスと全RNAシーケンスを実施した。腫瘍特異的な体細胞遺伝子変異を209個認め、そのうち発現を認めたもの43個について、患者が持つHLA-A*02:06, HLA-A*11:01, HLA-B*52:01, HLA-B*54:01, HLA-C*01:02, HLA-C*12:02に対する結合予測値をもとに54個のネオエピトープペプチドを合成した。患者から得たPBMCとペプチドパネルを共培養しIFN-γの産生をELISAでスクリーニングした(図3)。患者PBMCは、NFATC2IP遺伝子の283番目のアミノ酸のセリンがロイシンに変異したRLPLRM[L]EPLに反応してIFN-γを産生した。このペプチドはHLA-A*02:06に対する結合予測値(IC50)は163.8 nM、変異のないRLPLRM[S]EPLペプチドのIC50は、894.2 nMであった。
図3. ネオエピトープペプチドのパネルを用いたスクリーニング(INF-γの産生をELISAで測定した)
QuickSwitch™ カスタムテトラマーによるネオアンチゲン反応性T細胞の検出
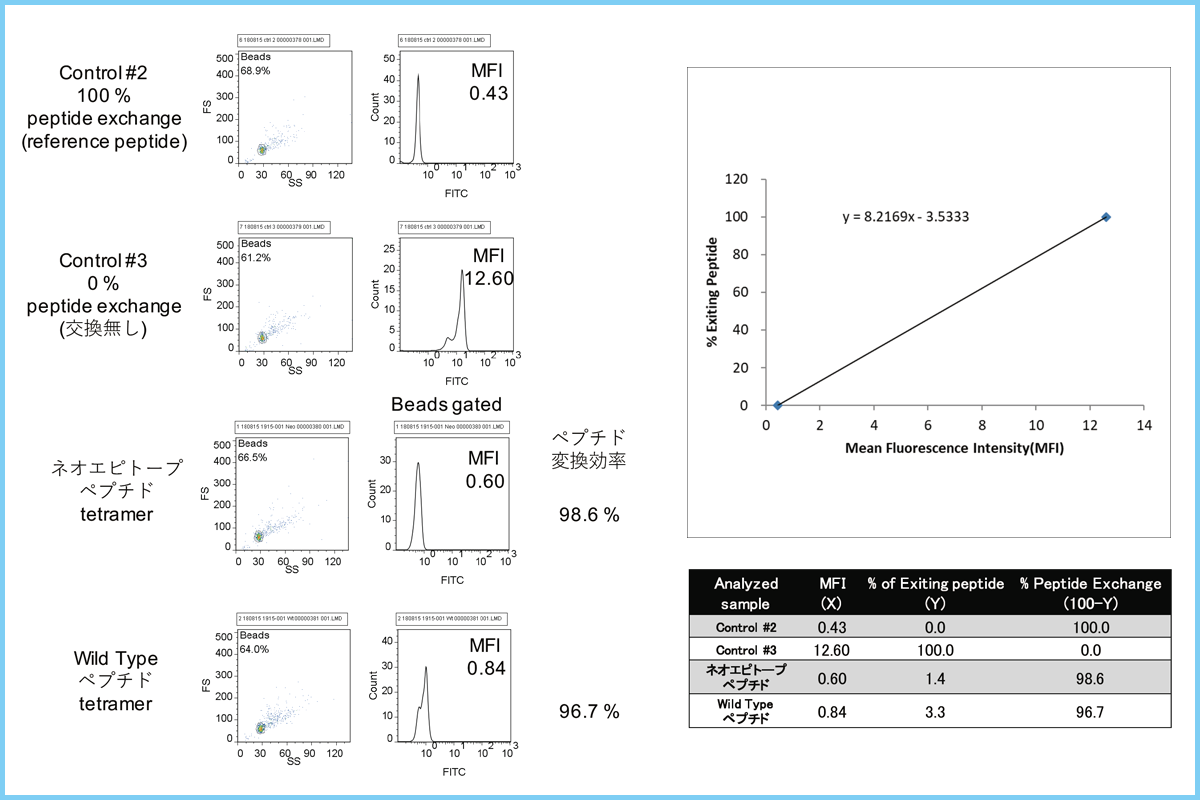
患者末梢血中にネオアンチゲン反応性T細胞が存在することを検証するため、患者のPBMCを、ネオエピトープペプチドをパルスした患者の樹状細胞(DC)とともに24日間培養し、ネオアンチゲン反応性T細胞を選択的に増殖させた後、テトラマー染色を試みた。QuickSwitch™ カスタム テトラマーキット(MBL)と合成したペプチドを用いて、研究室内でペプチド交換反応を行い、ネオエピトープペプチドとコントロールとなるWild typeテトラマーを調製した。ペプチド交換効率は、変異ペプチドとコントロールのWild typeペプチドそれぞれ98.6%と96.7%であった(図4)。
これらのテトラマーを用いて培養後の患者PBMCをCD8、CD3、Fixable Viability Dye eFluor™ 780、テトラマーで染色したところ、CD3陽性細胞中0.8%の細胞がテトラマー陽性を示し、患者末梢血中にネオアンチゲンに反応するT細胞が存在することが証明された(図5)。
  |
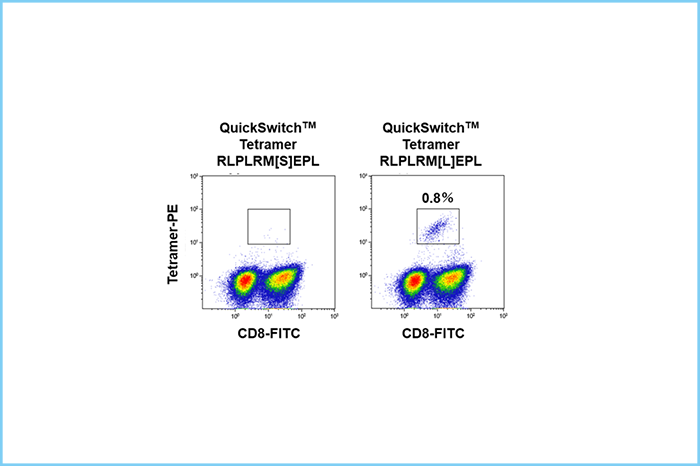  |
| 図4. QuickSwitch™ カスタムテトラマーキットによるネオアンチゲン特異的テトラマーの調製とペプチド交換高率の確認 | 図5. がん患者末梢血中のネオアンチゲン特異的T細胞の検出 |
ネオアンチゲン反応性T細胞のクロナリティ
HLA-A*02陽性の食道がん患者で同定されたDHX57遺伝子1049番目のアミノ酸アルギニンがシステインに変異したSIF[C]CLDPAネオエピトープに反応するT細胞をHLA-A*02が一致する健常人ドナーのPBMCから培養した。健常人においてネオアンチゲン反応性T細胞の頻度は非常に低いため、ペプチド刺激を2回実施して増幅させたのち、テトラマーで検出した。検出には、ペプチド交換法でネオエピトープペプチドを結合させたQuickSwitch™ カスタム テトラマーを用いた。培養細胞中のCD8陽性T細胞中の0.13%がテトラマー陽性であった。ネオアンチゲン反応性T細胞のクロナリティを評価するために、セルソーターを用いてテトラマー陽性細胞を分離した。RNA抽出後cDNAを調製し、TCR遺伝子を増幅させ、NGSを用いてCDR3領域遺伝子配列を解析した。TCRβ鎖のCDR3配列から、このドナーから得られたネオアンチゲン反応性T細胞は単一ではなく、少数のクローン(オリゴクローン)で構成されていることが明らかになった(図6)。
NGSを用いたTCR遺伝子解析法を用いても、末梢血中のネオアンチゲン反応性T細胞は検出感度以下であり、ペプチド培養刺激後でも、各クローンの頻度は0.1%に満たないほどわずかであった。テトラマー染色法を活用することで、このような希少なネオアンチゲン反応性T細胞を容易に濃縮し解析することが可能になった(図7)。
  |
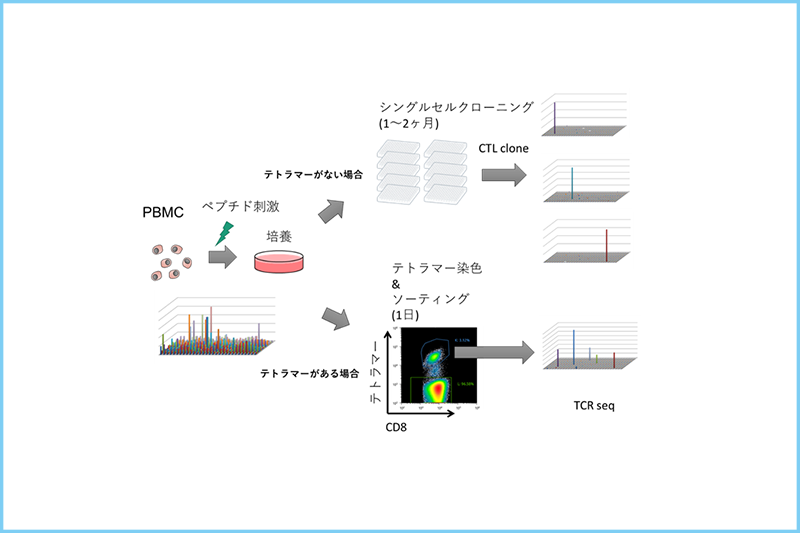  |
| 図6. テトラマーソーティングによるネオアンチゲン特異的T細胞の濃縮 | 図7. テトラマーを活用したネオアンチゲン反応性T細胞の同定とTCR解析 |
QuickSwitch™ カスタム テトラマーの有用性
ネオアンチゲン研究の厄介なところは、腫瘍には、複数の遺伝子変異が存在すること、個々の患者によってその遺伝子変異が異なること、そしてすべての変異遺伝子産物がネオアンチゲンになるわけではなく、患者のHLAによって結合し提示されるペプチドが異なることから、個々の患者毎に複数の固有のネオエピトープペプチドが候補になり、その検証が求められることである。
ペプチド/MHC複合体の4量体を用いて抗原特異的T細胞を検出するテトラマー技術は、抗原特異的T細胞を直接検出可能にした革新的な技術であったが、ペプチドとMHCクラスI分子、β2マイクログロブリンの3つの分子を適切にリフォールディングさせて会合させることは容易ではないため、最適化した条件下で既知のエピトープペプチドを用いて調製されたテトラマーのみ提供されていた。ウイルスや既知のがん抗原に由来するエピトープに対するテトラマーは入手可能であったが、個々の患者のネオアンチゲンのように、未知のエピトープペプチドに対するテトラマーの調製は困難であった。
QuickSwitch™ カスタム テトラマーは、MHCペプチド複合体の構造を維持するためにあらかじめExitingペプチドを用いて適切な立体構造を保ったテトラマーが提供される。
目的のネオエピトープペプチドを加えて、Peptide Exchange Factorを添加すると、化学反応によりExiting peptideと目的のペプチドの交換反応が起こり、ネオエピトープペプチドに置き換わったテトラマーが調製される。これにより同時に複数のネオエピトープペプチドに対するテトラマーの調製が可能になり、ハイスループットのネオアンチゲン反応性T細胞の検出系の構築が可能になる。QuickSwitch™ カスタム テトラマーは、今後ネオアンチゲンの研究には不可欠のツールとして、広く活用されると期待される。
参考文献
- Zappasodi R, Merghoub T, Wolchok JD. Emerging Concepts for Immune Checkpoint Blockade-Based Combination Therapies. Cancer cell. 2018;33(4):581-98.
- Schumacher TN, Schreiber RD. Neoantigens in cancer immunotherapy. Science (New York, NY). 2015;348(6230):69-74
- Blum JS, Wearsch PA, Cresswell P. Pathways of antigen processing. Annual review of immunology. 2013;31:443-73.
- Tureci O, Vormehr M, Diken M, Kreiter S, Huber C, Sahin U. Targeting the Heterogeneity of Cancer with Individualized Neoepitope Vaccines. Clinical cancer research : an official journal of the American Association for Cancer Research. 2016;22(8):1885-96.
- Hackl H, Charoentong P, Finotello F, Trajanoski Z. Computational genomics tools for dissecting tumour-immune cell interactions. Nature reviews Genetics. 2016;17(8):441-58.
- Karasaki T, Nagayama K, Kawashima M, Hiyama N, Murayama T, Kuwano H, et al. Identification of Individual Cancer-Specific Somatic Mutations for Neoantigen-Based Immunotherapy of Lung Cancer. Journal of thoracic oncology : official publication of the International Association for the Study of Lung Cancer. 2015.






