京都大学 増田 喬子 先生より
『iPS細胞技術を用いたがん抗原特異的T細胞の
再生と他家移植への応用』

増田 喬子 先生
京都大学 ウイルス・再生医科学研究所
再生免疫学分野 助教
【略歴】
| 平成13年03月 | 関西学院大学理学部化学科 卒業 |
| 平成17年04月〜平成19年03月 | 日本学術振興会 特別研究員 |
| 平成18年03月 | 京都大学大学院生命科学研究科博士後期課程修了、学位取得 |
| 平成19年04月〜平成20年12月 | 米ジョージア大学遺伝学部 ポスドク研究員 |
| 平成21年01月〜平成24年09月 | 独立行政法人 理化学研究所 免疫・アレルギー科学総合研究センター 研究員 |
| 平成24年10月〜平成28年09月 | 国立大学法人京都大学 再生医科学研究所 助教 |
| 平成28年10月〜現在 | 国立大学法人京都大学 ウイルス・再生医科学研究所 助教 |
がんの免疫細胞療法の現状と問題点
がんに対する三大療法である「外科手術」「放射線療法」「化学療法」に加えて「免疫細胞療法」が提唱されて久しいが、がんの標準治療になるほどの有効性を示すに至らない状況が長らく続いていた。しかし、がんの免疫細胞療法はこの数年で大きく進展した。それは抗CTLA-4抗体や抗PD-1抗体などの免疫チェックポイント阻害抗体の登場によるところが大きい。免疫チェックポイント阻害抗体を用いた臨床研究において、すでに何種類かの固形がんに対する有効性が実証されており1) 2) 3)、いくつかのがん種への適応は承認されている。しかしながら、有効率は20-30%にとどまる事、自己免疫疾患様反応を高率(~50%)に引き起こしてしまう事などが問題として挙げられている。これらの抗体は、免疫系の抑制機構を阻害することにより、細胞傷害性Tリンパ球(cytotoxic T lymphocyte; CTL)を活性化することで、がん細胞殺傷能力を増強する作用を期待して用いられている。しかし、抗原非特異的に免疫系を亢進するため、前述のように自己免疫疾患を惹起するという副反応が生じている。
一方でCTLそのものを用いる方法も研究され、その効果が確認されている。例えばアメリカ国立衛生研究所(NIH)のS.A. Rosenbergらは、悪性黒色腫を対象として、腫瘍に浸潤するリンパ球(tumor-infiltrating lymphocyte: TIL)を体外で増幅して戻すという方法を用いて、良い治療効果を得ている4)。他に、患者の末梢血中のT細胞にがん抗原特異的なT細胞受容体(T Cell Receptor: TCR)遺伝子を導入して体内に戻すという方法では、特定のがん種に対して一定の効果がみられている5) 6) 7)。ただし、TCR導入法は遺伝子治療となるため、遺伝子導入されたT細胞ががん化する可能性が残る。また、TIL法にしても、TCR導入法にしても、原則的に自家移植であり、患者から質の良いT細胞が得られることが前提となる。しかし、いずれの方法でも必要なT細胞を十分量にまで増幅するのは容易ではなく、「移入する細胞数が少ない」という問題点を克服するには至っていない。
初期化技術を利用したT細胞のクローニング
前項で述べたように、CTLを用いる方法では、良質な抗原特異的CTLを必要十分数だけ作製するのが困難であるという問題点があった。筆者らはこの問題点を克服するために、「初期化技術を用いてT細胞をクローニングする」というアプローチをとることにした(図1)。抗原特異的T細胞を初期化することで多能性幹細胞(ES細胞あるいはiPS細胞)を作製すると、その多能性幹細胞には再構成されたTCR遺伝子のゲノム構造が受け継がれる。その多能性幹細胞からT細胞を分化誘導すると、全てが元のT細胞と同じ反応性をもつT細胞になると考えられた。多能性幹細胞の段階で増幅することができるため、新鮮なT細胞を必要なだけ作製することができる。
そこで、筆者らはまず悪性黒色腫に発現するMART-1抗原に特異的なCTLからiPS細胞を作製した(MART1-T-iPS細胞)8)(図2A-C)。実験に利用した細胞は、NIHで悪性黒色腫の患者から分離され、培養されていたT細胞株である。次に作製したMART1-T-iPS細胞からT細胞を分化誘導した(図2D)。35日目にはCD4CD8共陽性細胞(double positive: DP細胞)が生成した(図2E)。この時点で、培地に抗CD3抗体を添加することによりTCR刺激を行った。6日後にはCD8陽性T細胞が出現し、この再生T細胞は、ほぼ全てがMART-1抗原を認識するTCRを発現していた(図2F)。
他家移植への応用 -T-iPS細胞バンクという構想とその利点-
上述の方法は、元の細胞を患者から採取し、再生して戻すという「自家移植」である。しかし自家移植の場合は、「医療費が高額」「必要な細胞作製に長時間を要する」「iPS細胞や再生CTLの品質保証が困難」などの問題がある。そこで筆者らは本法を「他家移植」に適応することを考えた。
例えば健常人から特定のがん抗原に対してT-iPS細胞を作製して、再生CTLの機能を検定した上で、そのT-iPS細胞もしくは再生CTLを凍結保存しておけば、同じHLAの人が同じがん抗原を発現するがんになった場合、解凍して即座に使うことができる。このことによって、患者ごとにiPS細胞をつくる必要が無くなるため、コストを大幅に削減することができる。また、有効性を事前に検定することが可能であるため、投与細胞の品質が保証されるという利点もある。なにより、患者が診断確定後に速やかに免疫細胞療法を受けられるようになるという大きな利点がある。
さらに、他家移植では「投与した細胞ががん化するリスクを回避できる」と考えられる。投与細胞は非自己の細胞であるため、いずれは拒絶されると考えられるからである。再生医療分野における多くの場合では、再生組織は移植後一生涯機能することが求められるが、免疫細胞療法の場合はその必要はなく、最終的に拒絶される事がむしろ利点とみなせるのである。
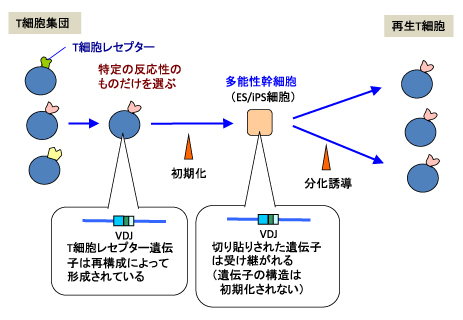
戦略のコンセプト。がん抗原特異的T細胞からES/iPS細胞を作製すると、そのES/iPS細胞には再構成されたT細胞受容体(TCR)遺伝子のゲノム構造が受け継がれる。そのES/iPS細胞から、T細胞を分化誘導すると、全てが元のT細胞と同じTCRをもつT細胞になる。
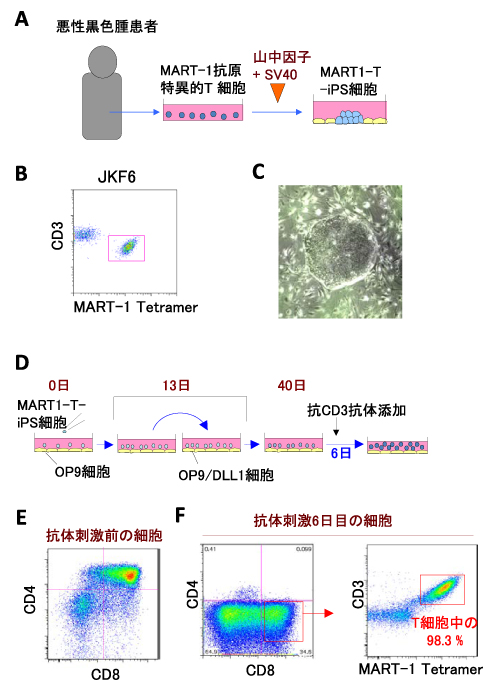
図2 iPS細胞技術を用いたMART-1抗原特異的T細胞の再生
- MART-1抗原特異的T細胞からiPS細胞を作製した(MART1-T-iPS細胞)。ヒト悪性黒色腫の患者から分離されたCTL細胞株に山中因子とSV40を導入し、iPS細胞を作製した。遺伝子の導入にはセンダイウイルスベクターを用いた。センダイウイルスベクターで導入した遺伝子はゲノムに組み込まれないので、遺伝子を傷つけることなくiPS細胞を作製できる。
- iPS細胞作製に用いたCTL細胞株にはMART-1抗原特異的CTLが含まれていた。
- MART1-T-iPS細胞コロニーの写真を示す。
- MART1-T-iPS細胞からMART-1抗原特異的T細胞を再生した。iPS細胞を2種類のフィーダー細胞(OP9細胞とOP9/DLL1細胞)と順次共培養したところ、培養40日目の細胞に抗CD3抗体を添加してTCR刺激を加えた。
- 培養40日目にはCD4/CD8 DP細胞が生成した。
- 抗CD3抗体を添加して6日間培養することでCTLが生成し、CD3陽性細胞のほとんどがMART-1抗原特異的CTLであった。
健常人のWT-1抗原特異的CTLからiPS細胞技術を用いてCTLを再生
WT-1抗原は、白血病や各種の固形がんに高頻度に発現するがん抗原である9)。筆者らは「WT-1特異的T細胞から作製したiPS細胞で他家移植」という方針に沿って、健常人の末梢血WT-1特異的CTLからのiPS細胞の作製とCTLの再生を試みた10)。通常、健常ボランティアの末梢血CD8陽性細胞中にWT-1抗原特異的CTLはほとんど含まれない。しかし、これらをWT-1ペプチドで刺激しながら培養することで、6週間後にはWT-1抗原特異的CTLをCD8陽性細胞の約半数にまで増殖させることができた(図3A)。これらの細胞を用いて、iPS細胞を作製した(図3B)。得られたiPS細胞から再生したT細胞はほぼ全ての細胞がWT-1抗原特異的CTLであった(図3C)。
図2で示した報告をした当時の技術では、再生したT細胞は抗原依存的に標的細胞を殺傷していたものの、通常のCTLとは異なるものであった。通常のCTLはCD8αとCD8βが結合したヘテロダイマー(CD8αβ)を発現しているのに対し、腸管に多いCD8陽性T細胞やγδT細胞の一部はCD8α分子2つが結合したホモダイマー分子(CD8αα)を発現している。CD8αβ分子はTCRの刺激を増強する副刺激分子として作用するが、CD8αα分子はそのような作用を持たないため、抗原特異的なシグナル伝達には適していない。当時、筆者らが再生したT細胞はCD8αα型であった。今回は、DP細胞をCD4CD8共陰性細胞(double negative: DN細胞)から分離した上で、刺激を加えた。そうすることで、CD8αβ型のT細胞が効率よく誘導できた(図3D)。また、分離しない状態で刺激した場合にCD8αβ型のT 細胞が生成しない原因は、刺激を受けたDN細胞がDP細胞を殺傷していたからということも判明した。
新しく工夫を加えた方法で再生したWT-1抗原特異的CTLは、元のCTLと比べてほぼ同等の殺傷能力を発揮した(図3E)。さらに、再生CTLはWT-1抗原を有している白血病細胞株を効率よく殺傷した。また、ヒト白血病細胞を免疫不全マウスに注入して作製する白血病モデルを用いた実験で、再生CTLを投与することにより、治療効果がみられた(図3F)。
再生CTLの安全性については、生体内で正常組織を傷つけないかという点と、投与した細胞自体ががん化しないかという点を確認した。免疫不全マウスに再生CTLだけを投与し6ヶ月間様子をみた結果、特にマウスの組織が傷害された徴候は認められず、また投与した細胞のがん化は起こらなかった。
CD8αβ型の再生CTLは、2-3ヶ月培養することで、一万倍以上に増やす事が可能であった。1回の分化誘導培養でDP細胞からCD8αβ型のCTLをおよそ106個作ることができるので、それらを引き続き増やすことで、計算上1010個以上のCTLを得ることができることになる。
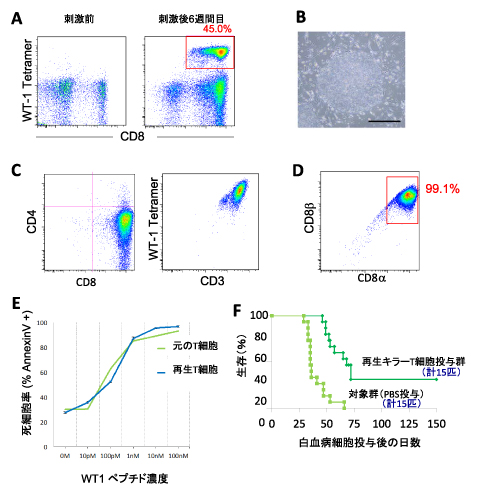
- 健常人の末梢血からWT-1抗原特異的キラーT細胞を増幅した。健常人末梢単核球をWT-1ペプチドで刺激することにより、6週間後にはCD8陽性細胞中にWT-1抗原特異的CTLが増幅した。
- Aで増幅したWT-1抗原特異的CTLからiPS細胞を作製した。
- 図2Dと同じ方法でiPS細胞からWT-1抗原特異的再生CTLを作製した。再生CTLはほぼ全ての細胞がWT-1抗原特異的CTLであった。
- DP細胞を単離して抗CD3抗体を用いてTCRを刺激することにより、効率よくCD8αβ型CTLを再生することができた。
- エフェクター細胞として元のCTL(凍結保存しておいたものを解凍して使用)と再生CTLを用い、標的細胞としてB細胞芽球様細胞株を用いた。標的細胞にさまざまな濃度でWT-1ペプチド抗原を添加し、T細胞対標的細胞が3:1になる割合で混合培養した。6時間後に、標的細胞の中の死細胞の割合を測定した。
- 免疫不全マウスにWT-1抗原を発現するヒト白血病細胞(HL60)を2x104個腹腔内に播種した。翌日から1週間ごとに計4回再生キラーT細胞5x106個をリン酸緩衝生理食塩水(PBS)に懸濁して腹腔内投与した。対照群では同じ量のPBSだけを腹腔内投与した。
TCR遺伝子導入法との併用と他家移植への応用
これまでにT細胞からiPS細胞を作るという方法でT細胞のクローニングをすると述べてきたが、より簡便に同じような効果を期待できるものとして、TCR遺伝子をiPS細胞に導入するという方法の開発を進めている。TCR遺伝子をレンチウイルスなどのベクターに入れてiPS細胞に導入する。導入されたTCR遺伝子は、多くの場合分化誘導過程で早期に発現するため、内因性のTCR遺伝子の再構成をいわゆる「対立遺伝子排除」の機構によって抑制する事が期待できる。
筆者らは図4で示したWT1-T-iPS細胞由来の再生CTLからTCR遺伝子をクローニングし、T細胞由来でないiPS細胞に導入した(WT1-TCR-iPS細胞)(図4A)。そのWT1-TCR-iPS細胞からもCD8αβ型のCTLを誘導することができ、その再生CTLはWT1-T-iPS細胞から再生したCTLと同等の抗原特異的細胞傷害活性を示した(データ非表示)。
この方法を他家移植の系で使えば、筆者らの戦略の汎用性が格段に高くなると考えている。導入するTCRとして、すでに効果や安全性が確かめられたTCR遺伝子を用いる方がよいと思われる。さらに京都大学iPS細胞研究所が提供しているHLAハプロタイプホモ型のiPS細胞ストック株を用いれば、こちらも品質が保証されているので、安全性の保証が得られやすいであろう(図4B)。
ただしこのTCR-iPS細胞法は、「幹細胞を用いる再生医療」である上にさらに「遺伝子治療」という二重の規制がかかる方法ではあるので、いかに安全性を担保するかが重要な課題となる。
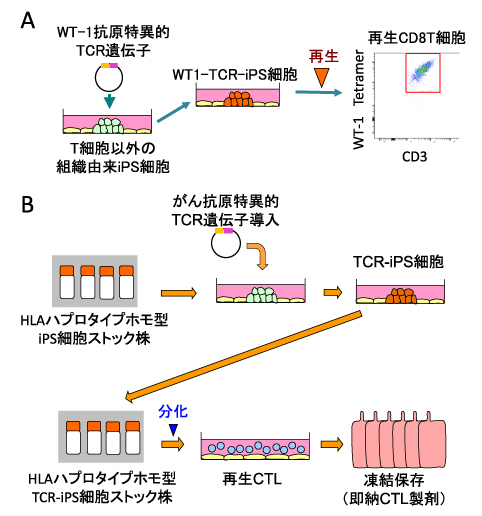
- WT-1抗原特異的TCR遺伝子をiPS細胞に導入し、WT1-TCR-iPS細胞を作製した。さらにこの細胞から再生CTLを作製した。この再生CTLはWT1-T-iPS細胞から再生したCTLと同等の抗原特異的細胞傷害活性を示した(データ非表示)。
- 京都大学iPS細胞研究所はHLAハプロタイプホモ接合型のドナーからiPS細胞を作製してストックする事業を進めている。このiPS細胞ストック株に、安全性と有効性が認められているがん抗原特異的TCR遺伝子を導入する事により、効率よく高品質なTCR-iPS細胞を作製することができる。種々のHLA型やがん抗原に対応した再生CTLを作製して凍結保存することにより、即納可能なCTL製剤のバンクを整備できると考えている。
おわりに
本稿では、再生医療でがんを対象とする可能性を提示してきた。ここで紹介したWT-1抗原は広くいろいろな固形がんで発現していることが知られている。また将来的には他のがん抗原やがんに固有の変異抗原を標的にすることにより、ほとんどのがんを対象にできるようになる可能性がある。TCR-iPS細胞法を用いれば、他のいろいろな抗原を標的とした戦略を取り入れやすい。
一方で抗原特異的な戦略は、特定のHLAを有している人しか対象にできないという制約がある。しかし、現時点で対象となっているHLA-A*24:02やHLA-A*02:01の場合、両者のいずれかを有している人は日本では約7割になるので、実際に対象となる患者は多い。将来的には他のHLA分子も対象になり、ほとんどの人をカバーできるようになることが期待できる。
一方、他家移植の場合は、移植に使うiPS細胞のHLA型という制約もある。京都大学iPS細胞研究所が供給するiPS細胞ストック株は、2017年8月現在では日本人に多いハプロタイプの上位2種類のホモ株が提供されており、日本人の23%がカバーされている。今後頻度の多い順に備蓄され、6-7年後には日本人の70-80%をカバーできるようになるとのことである。
その他にも課題は多いが、筆者らの再生T細胞を用いる戦略が実現すれば、がん治療に大きなブレイクスルーをもたらすことになると考えている。また、「即納型T細胞製剤」というアプローチは、がんに限らず、感染症、自己免疫疾患、アレルギーなど、免疫が関わる全ての疾患に適用できるようになると期待している。
文献リスト
- Hodi FS, O'Day SJ, McDermott DF, Weber RW, Sosman JA, et al.: Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med, 363: 711-723, 2010.
- Topalian SL, Hodi FS, Brahmer JR, Gettinger SN, Smith DC, et al.: Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. N Engl J Med, 366: 2443-2454, 2012.
- Wolchok JD, Kluger H, Callahan MK, Postow MA, Rizvi NA, et al.: Nivolumab plus ipilimumab in advanced melanoma. N Engl J Med, 369: 122-133, 2013.
- Rosenberg SA.: Cell transfer immunotherapy for metastatic solid cancer--what clinicians need to know. Nat Rev Clin Oncol, 8: 577-585, 2011.
- Morgan RA, Dudley ME, Wunderlich JR, Hughes MS, Yang JC, et al.: Cancer regression in patients after transfer of genetically engineered lymphocytes. Science, 314: 126-129, 2006.
- Johnson LA, Morgan RA, Dudley ME, Cassard L, Yang JC, et al.: Gene therapy with human and mouse T-cell receptors mediates cancer regression and targets normal tissues expressing cognate antigen. Blood, 114: 535-546, 2009
- Robbins PF, Morgan RA, Feldman SA, Yang JC, Sherry RM, et al.: Tumor regression in patients with metastatic synovial cell sarcoma and melanoma using genetically engineered lymphocytes reactive with NY-ESO-1. J Clin Oncol., 29: 917-924, 2011
- Vizcardo R, Masuda K, Yamada D, Ikawa T, Shimizu K, et al.: Regeneration of human tumor antigen-specific T cells from iPSCs derived from mature CD8+ T cells. Cell Stem Cell, 12: 31-36, 2013.
- Cheever MA, Allison JP, Ferris AS, Finn OJ, Hastings BM, et al.: The prioritization of cancer antigens: a national cancer institute pilot project for the acceleration of translational research. Clin Cancer Res., 15: 5323-5337, 2009
- Maeda T, Nagano S, Ichise H, Kataoka K, Yamada D, et al.: Regeneration of CD8αβ T cells from T-cell-derived iPSC imparts potent tumor antigen-specific cytotoxicity. Cancer Research. 76: 6839-6850, 2016



