理化学研究所 石井 保之 先生より
『NKT 細胞による免疫制御』

石井 保之 理学博士
理化学研究所 産業連携本部
創薬・医薬技術基盤プログラム プロジェクトリーダー
【略歴】
| 株式会社レグイミューン(REGiMMUNE Corp.)の創業者で現在は代表取締役会長 | |
| 1986 年 | 東京工業大学理学部化学科卒 |
| 1988 年 | 東京工業大学大学院総合理工学研究科生命化学専攻(大島泰郎教授)博士課程前期修了 |
| 1988-2000 年 | キリンビール株式会社医薬探索研究所勤務 |
| 1993-1996 年 | 米国サンディエゴのLa Jolla Institute for Allergy and Immunology(ラホヤアレルギー免疫研究所), Division of Immunochemistry(石坂公成博士研究室)留学 |
| 2000 年 | 通産省工業技術院(現 国立研究開発法人 産業技術総合研究所)主任研究官 |
| 2004 年 | 4月より理化学研究所 免疫・アレルギー科学総合研究センターワクチンデザイン研究チーム チームリーダー |
| 2013 年 | 4月の理研組織再編から2016年3月まで理研統合生命医科学研究センター ワクチンデザイン研究チーム チームリーダー |
| 2016 年 | 4月より現在まで、理化学研究所 産業連携本部 創薬・医薬技術基盤プログラム プロジェクトリーダー |
1.はじめに
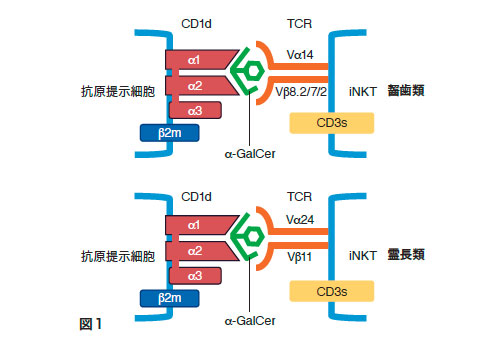
ナチュラル・キラーT(NKT)細胞は、細胞表面にナチュラル・キラー(NK)細胞のマーカー分子(CD161)とT細胞受容体(TCR)分子を発現し、NK細胞とT細胞両方の性質をもつ細胞として同定された1)。NKT細胞には、非古典的(nonclassical)主要組織適合抗原クラスI(MHCclass I)であるCD1d分子に拘束性があるタイプIとタイプII、及び非拘束性のサブセットが報告されている。CD1d拘束性NKT細胞のうち不変TCRα鎖を持つinvariant NKT(iNKT)細胞をタイプI、一方多様なTCRα鎖を持つCD1d拘束性NKT細胞はタイプIIに分類される。マウスiNKT細胞では不変TCRα鎖はVα14-Jα18でTCRβ鎖は多様性がありVβ8.2、Vβ7、Vβ2の順に多い。ヒトNKT細胞では不変TCRα鎖はVα24-Jα18でTCRβ鎖もVβ11に限定されている。またイヌにおいてもiNKT細胞が同定され、マウスVα14-Jα18とヒトVα24-Jα18に相同性が高い不変TCRα鎖が遺伝子クローニングされている(図1)。iNKT細胞の割合は末梢血リンパ球中ではマウスで1%前後、ヒトでは0.01-1%と低い[2]。しかしながら、肝臓や骨髄には多く存在することが知られている[3,4]。
2.iNKT細胞リガンド化合物
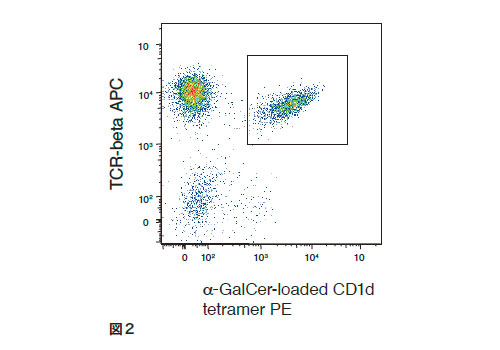
iNKT細胞を活性化する代表的なリガンド化合物はα-galactosylceramide(α-GalCer)である。α-GalCerのシードは天然物化合物であり、沖縄近海に生息する海綿(agelas mauritianus)から抽出された[5]。その後、胆癌ヌードマウスを用いた抗腫瘍効果を指標にα-GalCer(KRN7000)が化学合成された[6]。α-GalCerは抗原提示細胞上に発現するCD1d分子に提示され、iNKT細胞を特異的に活性化し、Th1応答に関係するIFN-γ , またTh2応答に関係するIL-4やIL-13等の様々なサイトカインを産生することによって、自然免疫と獲得免疫の橋渡しをしている[7]。α-GalCerをC57BL6マウスの尾静脈から投与3日後には、脾臓中にB220 陰性TCR 陽性αGalCer/CD1dテトラマー陽性のiNKT細胞が顕著に認められる(図2)。
3.iNKT細胞サブセット
iNKT細胞は様々なサブセットに分類できることが報告された。ヒトではCD4陰性iNKT細胞はIFN-γを主に産生するのに対して、CD4陽性iNKT細胞はTh1とTh2両方のサイトカインを産生する能力がある[8,9]。またマウスでもCD4陰性iNKT細胞はCD4陽性iNKT細胞よりもTh1サイトカイン産生優位でかつ、高い抗腫瘍活性を示すことが報告されている[10]。さらにマウスiNKT細胞は、転写因子の発現によって群分けできることも提唱されている[11]。Th2のマスター遺伝子であるGata-3を発現するiNKT細胞はIL-12受容体、IL-15受容体、CXCR3を細胞表面に発現し、IFN-γとIL-4の両方を産生し(タイプ1)、またTh1のマスター遺伝子であるT-betを発現するiNKT細胞はIL-25受容体(IL-17RB)、CCR4を細胞表面に発現し、IL-4とIL-13を産生する(タイプ2)。さらにRORγtを発現するiNKT細胞はIL-23受容体とCXCR6を発現しIL-17AやIL-22を産生する(タイプ3)。iNKT細胞タイプ2は、IL-25で誘発されるマウス気道過敏症の増悪化に関係している12-14)。またiNKT細胞を定義する共通転写因子としてPLZFの発現が報告されている[15]。さらにPLZF発現がないiNKT細胞が脂肪組織中に存在していて、主にIL-2とIL-10を産生する等の抑制性の機能を持つことも報告されている[16]。以上のような様々なiNKT細胞サブセットを解析するためには、フローサイトメーターによる高度な細胞分析・ソーティング技術が求められる。
4.α-GalCer刺激によるiNKT細胞の変化
生体内では様々なiNKT細胞サブセットが分化・増殖して感染防御や抗腫瘍作用を制御していることが示唆されるが、内在性のどの化合物がリガンドとなってiNKT細胞を活性化しているかは未解決である。生体内に存在するα-GalCer類似化合物が同定されたが、CD1d上に提示された化合物とiNKT細胞上のTCRとの親和性はα-GalCerよりも20倍以上低いことが報告されている[17]。この報告は、α-GalCerのような強い親和性を持つリガンド化合物では、生体内のiNKT細胞を正常に制御できない可能性を示唆している。事実、α-GalCer水溶液のマウスへの静脈内投与では、1回目の投与後に認められる血中でのIFN-γ産生が2回目以降の投与後には認められないことが報告されている[18-20]。iNKT細胞の不応答(アナジー)とも言える現象は、α-GalCerの臨床試験においても認められている[21]。しかしながら、その後のiNKT細胞の抗腫瘍活性、特にIFN-γの産生を増強させるためのリガンド化合物の探索研究も、ほぼ全てがCD1dとTCRの親和性を高める設計が施された。α-GalCerよりも高い親和性を持つリガンド化合物DB06-1を1回投与後、1ヶ月目に2回目の投与を行ってもIFN-γの産生は回復しなかったが、逆にIL-10産生は優位に上昇することが報告されている[22]。このiNKT細胞のアナジーの誘導メカニズムとして、骨髄由来のある種の細胞が関与していることが示唆されている[23]。
5.iNKT細胞の免疫制御機能とその応用
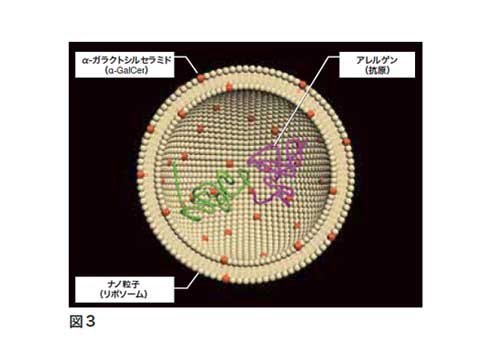
iNKT細胞の抗腫瘍活性はα-GalCerおよびその他多くの高親和性のリガンド化合物の静脈内単回投与でのみ認められる可能性が示唆されたが、一方免疫抑制が必要なアレルギー・自己免疫疾患や移植の領域では複数回投与によるiNKT細胞の制御機能が重要な役割を示すことが報告されている。例えばα-GalCer水溶液をマウスに3回投与することによって、iNKT細胞のサイトカイン産生はIL-10優位に偏重し、免疫寛容性DCの増殖も認められた。我々はリポソーム化α-GalCerリポソーム製剤を開発し、単回投与でもiNKT細胞のIL-10産生を増強し、IFN-γ産生を抑制する作用機序を解明した(図3)。リポソーム化α-GalCerはマウス尾静脈内に投与後、脾臓辺縁帯CD21hiCD23lowB細胞に優先的に取り込まれ、iNKT細胞との会合によって、B細胞からのIL-10産生量はiNKT細胞からのIL-10産生をはるかに上回ることを明らかにした[24]。その後脾臓内では免疫寛容性CD11clowCD45RBhi細胞が増殖し、逆にコンベンショナルなCD11chiDCが減少する現象を見出し、CD11clowCD45RBhi細胞とRAG欠損マウス由来CD4+CD25-T細胞とのin vitroの培養系ではFoxp3+制御性T細胞(Treg)への分化を認めた[23]。またIgE産生アレルギーマウスに対するリポソーム化α-GalCerのin vivoでの効果は、抗原感作3日前の単回投与によって、抗原特異的IgEとIgG両方の抗体産生が優位に抑制された[24]。以上の結果から、デタージェントで水溶化したα-GalCerの複数回投与によって誘導されるiNKT細胞の免疫制御機能を、リポソーム化α-GalCerは単回投与で引き出すことができることが明らかになった。
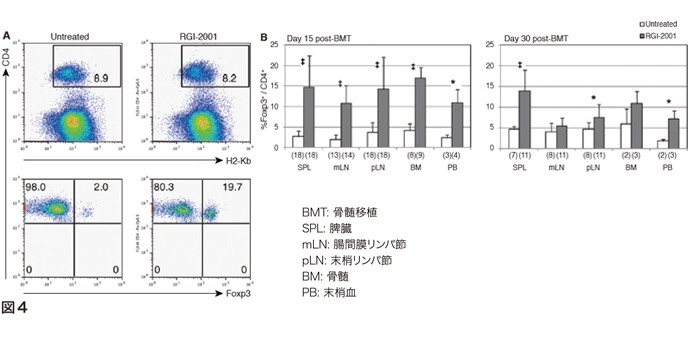
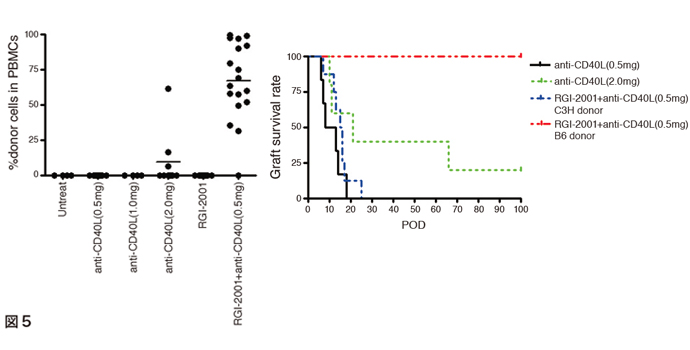
リポソーム化α-GalCerの臨床応用は移植分野で先行している。移植片対宿主病(GVHD)発症モデルマウスを用いた試験では、移植直後のリポソーム化α-GalCerの投与によって、ドナーTregが増殖しマウスの生存率が著しく改善されることが認められた(図4)[25]。この非臨床試験データに基づき、リポソーム化α-GalCerの治験薬製剤RGI-2001を使った臨床試験が米国実施されている(NCT01379209)。RGI-2001を投与して血中Tregが上昇した患者の急性GVHD発症率が極めて低かったことが報告されている[26]。また移植後21日目までに血中Treg割合が著しく上昇した患者では慢性GVHDの発症も抑制されていることが試験後調査で認められている。臓器移植へのRGI-2001の応用については、正常レシピエントマウスに亜致死性放射線照射後に、ドナーマウス骨髄細胞をRGI-2001と抗CD40リガンド中和抗体を同時投与することによって、混合骨髄キメラ形成と移植ドナー心臓の長期生着が認められた(図5)[27]。骨髄移植前から当日に抗CD25中和抗体を大量投与してTreg増殖を阻害すると混合キメラ形成が解除されたが、移植14日後以降に抗CD25中和抗体を大量投与しても混合キメラ形成に影響がなかったことから、移植直後のレシピエント由来Tregの増殖が混合キメラ形成に必須であることが示唆された[28]。
5.終わりに
20世紀後半にキリンビール株式会社の研究者たちが沖縄の海綿から抽出したアゲラスフィン類を、抗腫瘍活性を指標に最適化して全合成したα-GalCerが、実は静脈内への複数回投与では抗腫瘍活性よりも免疫制御活性が高まる事実は21世紀になるまで知られていなかった。現在、iNKT細胞の抗腫瘍活性を誘導する方法として、α-GalCerパルスDC療法や人工アジュバントベクター法が開発され、α-GalCerを用いた癌治療はまた脚光を浴び始めている。一方、リポソーム化α-GalCerは単独で投与することによってiNKT細胞の免疫制御機能を選択的に引き出せることから、移植免疫寛容誘導に限らず炎症性腸疾患(潰瘍性大腸炎とクローン病)、自己免疫疾患(I型糖尿病や多発性硬化症)、アレルギー疾患の治療、さらには酵素補充療法における酵素活性阻害IgG抗体やアナフィラキシーの原因になるIgE抗体の産生抑制に応用できるポテンシャルを持っている。
文献リスト
- Yankelevich B, Knobloch C , et al. (1989) A novel cell type responsible for marrow graft rejection in mice. T cells with NK phenotype cause acute rejection of marrow grafts. J Immunol 142:3423-3430.
- Lee PT, Putnam A, et al. (2002) Testing the NKT cell hypothesis of human IDDM pathogenesis. J Clin Invest 110:793-800.
- Makino Y, Kanno R, et al. (1995) Predominant expres- sion of invariant Vα14+ TCR α chain in NK1.1+ T cell populations. Int. Immunol. 7:1157–1161.
- Koseki H, Imai K, et al. (1990) Homo- genous junctional sequence of the V14+ T-cell antigen receptor α chain expanded in unprimed mice. Proc. Natl. Acad. Sci. USA 87:5248–5252.
- Natori T, Morita M, et al., (1994) Agelasphins, novel antitumor and immunostimulatory cerebrosides from the marine sponge agelas-mauritianus. Tetrahedron 50:2771-27784.
- Morita M, Motoki K, Akimoto K, et al. (1995) Structure-activity relationship of alpha- galactosylceramides against B16-bearing mice. J Med Chem 38:2176-2187.
- Brennan, P.J., Brigl, M. & Brenner, M.B. (2002) Invariant natural killer T cells: an innate activation scheme linked to diverse effector functions. Nat. Rev. Immunol. 13, Feb;13(2):101-117.
- Gumperz JE, Miyake S, et al. (2002) Functionally distinct subsets of CD1d-restricted natural killer T cells revealed by CD1d tetramer staining. J Exp Med 195: 625–636.
- Lee PT, Benlagha K, et al. (2002) Distinct functional lineages of human Va24 natural killer T cells. J Exp Med 195: 637–641.
- Crowe NY, Coquet JM, et al. (2005) Differential antitumor immunity mediated by NKT cell subsets in vivo. J Exp Med 202: 1279–1288.
- Constantinides MG, McDonald BD, et al. (2014) A committed precursor to innate lymphoid cells. Nature 508(7496):397-401.
- Terashima A, Watarai H, et al. (2008) A novel subset of mouse NKT cells bearing the IL-17 receptor B responds to IL-25 and contributes to airway hyperreactivity. J Exp Med 205: 2727–2733.
- Stock P, Lombardi V, et al. (2009) Induction of airway hyperreactivity by IL-25 is dependent on a subset of invariant NKT cells expressing IL-17RB. J Immunol 182: 5116–5122.
- Watarai H, Etsuko Sekine-Kondo, et al. (2012) Development and function of invariant natural killer T cells producing TH2- and TH17-cytokines. PLoS Biol. 10, e1001255.
- Savage, AK, Constantinides MG, et al. (2008) The transcription factor PLZF directs the effector program of the NKT cell lineage. Immunity 29, 391–403.
- Kovalovsky, D, Uche OU, et al. (2008) The BTB-zinc finger transcriptional regulator PLZF controls the development of invariant natural killer T cell effector functions. Nat. Immunol. 9, 1055–1064.
- Kain L, Webb B, et al. (2014) The identification of the endogenous ligands of natural killer T cells reveals the presence of mammalian α-linked glycosylceramide. Immunity 41, 543-554.
- Fujii S, Shimizu K, et al. (2002) Prolonged IFN-g-producing NKT response induced with a-galactosylceramide-loaded DCs. Nat. Immunol. 3: 867–874.
- Parekh VV, Wilson MT, et al. (2005) Glycolipid antigen induces long- term natural killer T cell anergy in mice. J. Clin. Invest. 115: 2572–2583.
- Uldrich AP, Crowe NY, et al. (2005) NKT cell stimulation with glycolipid antigen in vivo : costimulation-dependent expansion, Bim-dependent contraction, and hyporesponsiveness to further anti- genic challenge. J. Immunol. 175: 3092–3101.
- Giaccone G, Punt CJ, et al. (2002) A phase I study of the natural killer T-cell ligand alpha-galactosylceramide (KRN7000) in patients with solid tumors. Clin Cancer Res. 8(12):3702-3709.
- Birkholz AM, Girardi E, et al. (2015) A Novel Glycolipid Antigen for NKT Cells That Preferentially Induces IFN-γ Production. J Immunol. 195(3):924-933.
- Wingender G, Birkholz AM, et al. (2015) Selective Conditions Are Required for the Induction of Invariant NKT Cell Hyporesponsiveness by Antigenic Stimulation. J Immunol. 195(8):3838-3848.
- Ishii Y, Nozawa R, et al. (2015) Selective Conditions Are Required for the Induction of Invariant NKT Cell Hyporesponsiveness by Antigenic Stimulation. J Immunol. 195(8):3838-3848.
- Duramad O, Laysang A, et al. (2011) Pharmacologic Expansion of Donor-Derived, Naturally Occurring CD4(+)Foxp3(+) Regulatory T Cells Reduces Acute Graft-versus-Host Disease Lethality Without Abrogating the Graft-versus-Leukemia Effect in Murine Models. Biol Blood Marrow Transplant 17(8):1154-1168.
- Chen Y-B, Efebera YA, et al. (2016) The Safety and Tolerability of RGI-2001 in the in vivo Modulation of Regulatory T-cells (Tregs) in Patients Undergoing Allogenic Hematopoietic Stem Cell Transplantation (AHSCT) in a First-in-Human (FIH) Phase I/IIa Dose-Finding Study. 42nd Annual Congress of the European Group for Blood and Marrow Transplantation, Valencia, Spain, April 2006
- Hirai T, Ishii Y, et al. (2014) A Novel Approach Inducing Transplant Tolerance by Activated Invariant Natural Killer T Cells with Co-stimulatory Blockade. Am J Transplant 14(3):554-567.
- Hirai T, Ishii Y, et al. (2016) Clonal Deletion Established via Invariant NKT Cell Activation and Costimulatory Blockade Requires In vivo Expansion of Regulatory T cells. Am J Transplant 16(2):426-439.



