
蛍光標識の種類
| 蛍光物質名 | |
|---|---|
| 蛍光色素(低分子蛍光色素) | FITC(Fluorescein Isothiocyanate)、Alexa Fluor®色素、Cy色素など |
| 蛍光タンパク質 | PE(Phycoerythrin)、APC(Allophycocyanin)など |
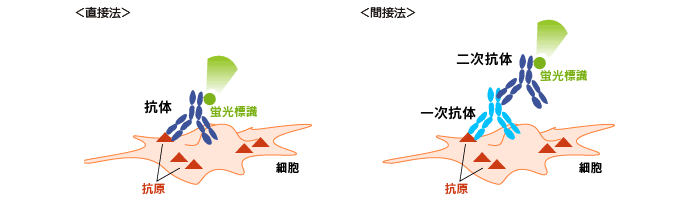
直接法、間接法
一次抗体に直接蛍光標識を付けて検出する場合(直接法)と、蛍光標識した二次抗体を一次抗体と反応させて検出する方法(間接法)があります。直接法の場合、蛍光染色では多重染色を容易に行うことができます。その場合、蛍光同士が干渉しないような組み合わせを考える必要があります。
| メリット | デメリット | |
| 直接法 |
|
|
| 間接法 |
|
|
実験の流れ(蛍光免疫染色、間接法)
各工程の意義
▌ 細胞固定
細胞固定は、細胞の形態の安定化や酵素の不活化を目的として行われます。抗原や抗体の種類により最適な固定法があるため、最良の結果を得るためには固定液の種類の検討のほか、固定時間や処理温度の検討が必要になります。
| アルデヒド系 | ホルムアルデヒド、パラホルムアルデヒド、ホルマリン(ホルムアルデヒド水溶液)は最も一般的に用いられている架橋剤です。タンパク質や核酸のアミノ基(-NH2)と反応して可逆的結合を形成します。パラホルムアルデヒドを用事調製して使用することもあります。 |
| 有機溶媒 | メタノール、エタノール、アセトンをなどの有機溶媒を固定液として使用する場合もあります。この場合、細胞内の脂質が除かれるため、膜タンパク質など脂質結合タンパク質を検出する際には使用できません。 |
▌ 膜透過処理
ホルムアルデヒドなどで固定化処理を行った場合には、抗体が細胞膜や核膜内部へ浸透できるように界面活性剤を用いて膜透過処理を行います。Triton X-100やNP-40が一般的に用いられます。この処理も目的タンパク質により界面活性剤の種類・濃度や処理時間を検討する必要があります。
▌ ブロッキング
一次抗体、二次抗体による非特異染色を防ぐために行います。ブロッキング剤にはBSAや二次抗体の宿主動物と同じ動物の血清が用いられます。
▌ 対比染色
目的タンパク質の染色とは対照的な色の染色を行い、細胞内の特定の構造物を可視化するために行います。DAPIやHoechstは細胞内の2本鎖DNAに結合し、青色蛍光を発する試薬として一般的に用いられており、核の形状を把握するために有用な方法です。
準備が必要なもの
・染色したい細胞(接着性が強い細胞が望ましい)
・ガラス底ディッシュ(研究機関によりさまざま)
・ポリLリシン(PLL)、コラーゲンなど(細胞接着性を高めるため、ディッシュをコートした方がよい場合があります)
・細胞固定液(4%パラホルムアルデヒド、ホルマリン、メタノールなど)
・界面活性剤(NP-40, Triton X-100, Tween20など)
・ブロッキング剤(BSA、血清など)
・PBS
・0.05~0.2% Tween20/PBS (PBS-T)
・一次抗体
・蛍光標識二次抗体
・DAPI
・水溶性封入剤
方法(細胞培養・標本作製)
※当社におけるNRK細胞を用いた細胞標本作製の一例をご紹介いたします。
1. 細胞培養
 NRK細胞を10 cmシャーレで培養する。70%コンフルエント程度になったら細胞を回収して細胞数をカウントします。
NRK細胞を10 cmシャーレで培養する。70%コンフルエント程度になったら細胞を回収して細胞数をカウントします。
2. 細胞播種―①
6wellカルチャースライドに、オートクレーブをかけた18 mm×18 mmのカバーガラスを置きます。
3. 細胞播種―②
5×105 cells/mLに調整した細胞溶液をカバーガラスの上に200 µL滴下します。(1×105/well)
その後、37℃ 5%CO2インキュベーターで1時間程度培養します。
4. 細胞播種―③
37℃ 5%CO2インキュベーターで1時間程度培養した後、培地を2 mLずつ足し、さらに一晩培養します。
5. 細胞播種―④
 ※ここではオートファジー比較のため、NutrientとStarvedの処理を行いました。特に処理する必要がない場合は、6. 細胞固定へ。
※ここではオートファジー比較のため、NutrientとStarvedの処理を行いました。特に処理する必要がない場合は、6. 細胞固定へ。
翌日、顕微鏡で細胞が接着していることを確認したのち、培地をアスピレーターを用いて取り除きます。Nutrientのwellには10%FCS-RPMIを200 µL滴下し、StarvedのwellにはRPMIを200 µL滴下します。その後、37℃ 5%CO2インキュベーターで3時間程度培養します。
6. 細胞固定
顕微鏡で細胞が接着していることを確認します。培地を捨て、PBSで細胞を1回洗浄した後、4%パラホルムアルデヒド溶液を200 µLを静かに添加し、室温で10分間静置します。
7. 膜透過処理
細胞固定液を除いてPBSで5分ずつ2回洗浄し、100 µg/mL Digitonin in PBS (SIGMA D141-100MG)を200 µLずつ滴下し、室温で10分間静置します。
8. 一次抗体反応
上清を除いてPBSで2回洗浄した後、PBSで希釈した一次抗体をそれぞれ200 µLずつ滴下し、室温で1時間反応させます。
9. 蛍光標識または酵素標識二次抗体反応
PBSで3回洗浄した後、PBSで500倍に希釈した二次抗体を200 µLずつ滴下し、アルミホイルを被せて遮光しながら、室温で30分反応させます。
10. 対比染色
PBSで3回洗浄した後、DAPI(1 µg/mL)を100 µL添加し、遮光しながら室温で30分間反応させます。
11. 封入
PBSで3回洗浄した後、封入して蛍光顕微鏡で観察します。



