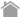タンパク質の分子量の差を利用して分離するタンパク質分析法です。
原理
ゲル中のタンパク質を電気泳動させると、小さなタンパク質ほどゲルの網目にひっかからずに早く移動するので、分子量の順にタンパク質を分離することができます。ゲルの編み目を通り抜ける速さは、個々のタンパク質の分子量だけでなく、高次構造や電荷などの影響を受けます。
タンパク質の高次構造や電荷などの影響をできるだけ排除し、ペプチド鎖長のみが反映された泳動結果を得るために、SDS (Sodium dodecyl sulfate = Sodium lauryl sulfate)とポリアクリルアミドゲルを利用した電気泳動系がSDS-PAGEです。
SDSはタンパク質の主ペプチド鎖部分に一定の割合で結合する性質があり、タンパク質変性作用が強い界面活性剤です。そのため、タンパク質はSDSの存在(かつタンパク質の立体構造形成上重要なジスルフィド結合を切断するような還元条件)下では、ペプチド鎖長に応じた負電荷を持ち、一様に直鎖状に近い構造を取ることになります。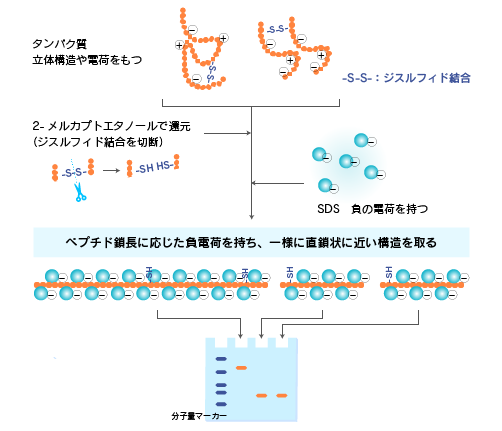
他方、重合したアクリルアミド(ポリアクリルアミド)は一般的な分子量のタンパク質を分離するのに適切な大きさの網目構造を持ち、硬度も取扱いしやすいものです。SDSを作用させたタンパク質試料をポリアクリルアミドゲル中で電気泳動することで、容易・安価・比較的正確にペプチド鎖長に応じてタンパク質を分離することができます。
方法
| 作業内容 | |
|---|---|
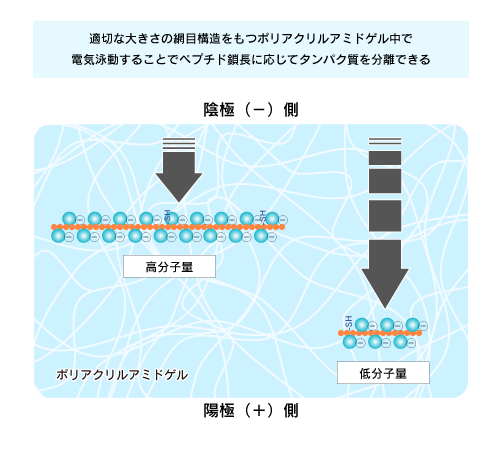
| コーム、ガラス板、スペーサー(シリコンチューブ)、クリップを用意します。 コームはサンプルを入れる穴(レーン)を作製するためのもので、サンプルの数に合わせて変えます。 例)サンプル7種類=8レーン用のコーム ※分子量マーカー分を考慮します。 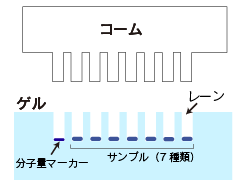 |
 |
| ガラス板をエタノールでよく拭き、ゲルの鋳型を組み立てます。 |  |
分離用ゲルバッファーを注入し、次に、分離用ゲルバッファーの上に水を重層します。空気(酸素)により重合が阻害されるので、ゲルが空気に触れないようにするためです。20-30分静置すると、アクリルアミドが重合し、固まります。重層した水は捨てます。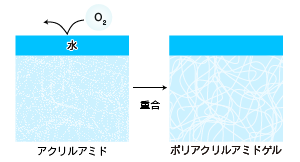 タンパク質の移動度は分離ゲルのアクリルアミド濃度にも依存するので、目的のタンパク質量に応じて適当な濃度のゲルを作製します。 アクリルアミドの濃度を高くするほど網目構造が細かく、小さいタンパク質を分離するのに適したゲルができます。 一般的には6〜15%の間で適当な濃度を設定します。 アクリルアミドの濃度勾配をつけたゲル(グラジエントゲル)を使う方法もあります。 |
 |
| 濃縮用ゲルバッファーを注入し、最後にコームを挿入して、静置します。 濃縮用ゲルはサンプルを分離ゲルで分離する前に、高濃度に濃縮する役割を果たします。濃縮される原理は下図に示すようにグリシンイオンと塩化物イオン、タンパク質の移動速度の差によります。 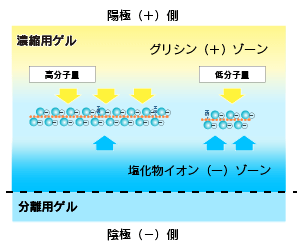 |
 |
![]()
| 作業内容 | |
|---|---|
| サンプルバッファーをサンプルに加え、指先で軽くはじきながら懸濁します。 100℃に熱したヒートブロック上で、3分間加熱します。 15,000 rpm、1分間、4℃で遠心し、上清をSDS-PAGEに用います。 |
 |
![]()
| 作業内容 | |
|---|---|
| クリップ、スペーサー、コームを外してから、泳動槽にゲル板をセットし、クリップで固定します。 泳動槽の上層と下層に泳動バッファーを入れて、レーンの内部、ゲル板の下の気泡やゲルの破片をシリンジで取り除きます。 |
 |
| サンプルおよび分子量マーカーをレーンに注入します。 |  |
電気泳動を行い、サンプルバッファーに添加されている色素(BPB)がゲルの下部に到達したら泳動を止めます。 |
|
| ゲル板を泳動装置から外し、ヘラを使ってゲルをガラス板から外し、次の実験作業に移ります。 |