マウス胆管オルガノイド培養方法
概要
マウス胆管のオルガノイド培養方法について、肝臓組織処理からオルガノイド培養までをご説明します。
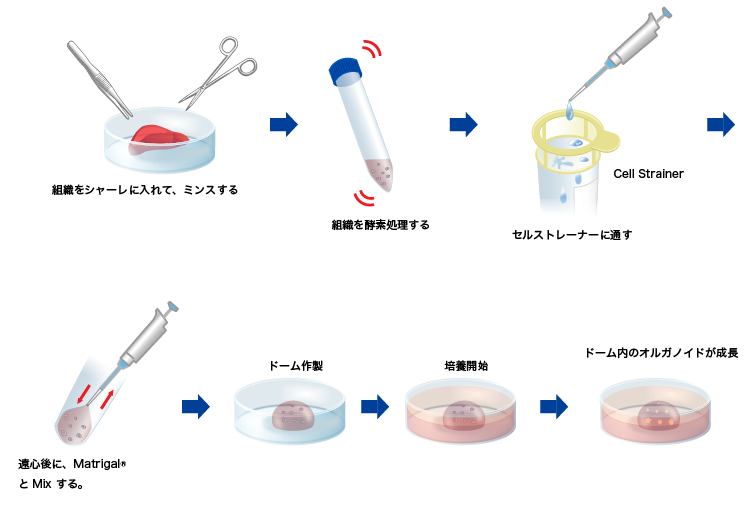
方法:肝臓組織酵素処理~オルガノイド培養
| 手順 | |
|---|---|
| ①肝臓組織(1 g程度)をPBSにて3回洗浄する。 |  |
| ②洗浄した組織を氷上のシャーレに置き、滅菌済み鋏でおおよそ1 mm角になるまでミンスする。 |
|
| ③ミンスした組織片を50 mLチューブに回収する。 | |
| ④組織分散液(10 mL)を加え懸濁する。 |
|
| ⑤組織分散液を加えた50 mLチューブを37°Cで30分振とうする。 |
|
| ⑥30分後に組織片が分散されていることを確認する。 |  |
| ⑦30 mLのBasal mediumを加えて、セルストレーナー(メッシュサイズ:100 µm)を50 mLチューブにセットし、組織懸濁液を通す。 | |
| ⑧遠心(400 g × 3分、室温)し、上清を除去する。 | |
| ⑨30 mLのBasal mediumを加えて、ペレットを懸濁する。 | |
| ⑩遠心(400 g × 3分、室温)し、上清を除去する。 | |
| ⑪1 mLのBasal mediumを加えて懸濁する。 | |
| ⑫一部を採取し、同量のTrypan Blue Solutionと混和して細胞を染色し、生細胞数をカウントする。 | |
| ⑬48-well plateの1ウェルに2,000 - 5,000 cells播種するため、播種するウェル分の細胞を⑪から1.5 mLチューブに採取し、氷上におく。 | |
| ⑭⑬の細胞懸濁液にMatrigel®を加えて細胞密度を100,000 - 250,000 cells/mL(2,000 - 5,000 cells/20 µL)に調製する。 | |
| ⑮48-well plateに20 µLずつ播種してドームをつくる。 | |
| ⑯37°Cインキュベーターで10~15分ほど加温してゲル化させる。 | |
| ⑰250 µL/ウェルのOrganoid Growth Mediumを添加してインキュベーターで培養する。 | |
| ⑱2-3日毎にOrganoid Growth Mediumで培地交換を行う。 | |
※継代、凍結ストックの作製、起眠はヒト腸オルガノイド培養工程をご覧ください
マウス胆管オルガノイドの樹立例
上記プロトコルのとおり、マウス肝組織から調製した細胞懸濁液にMatrigel®を加え細胞密度2,000 cells/20 µLとなるように調製、プレートに播種し培養した結果、オルガノイドの形成が確認できた。

その他の培養工程
 マウス胆管オルガノイド培養方法トップ
マウス胆管オルガノイド培養方法トップ- ヒト腸オルガノイド培養方法トップ
