Atgファミリーの働き
APG/ATG遺伝子の発見
近年脚光をあびているオートファジーですが、実は40年以上も前にすでに電子顕微鏡により観察されていました。しかしながら、その過程に関係する因子が長らく不明であったため、オートファジーの機能解析はなかなか進みませんでした。
基礎生物学研究所(現・東京工業大学)の大隈良典先生らは、オートファゴソームの内包物をうまく消化できない酵母株を作製し、オートファジー関連遺伝子群 (Autophagy related gene:APG/ATG) のクローニングに成功しました(Tsukada and Ohsumi,1993)。現在では出芽酵母におけるATG遺伝子は41種類知られ(2016年)、これらの多くは哺乳類や植物においても保存されています(種間のアミノ酸配列の相同性は低いようですが、立体構造が似ています)。
これらAPG/ATG遺伝子群の発見を契機に、各タンパク質の機能解析は精力的に行われ、オートファジーの機構と役割の詳細が次々とあきらかにされています。
オートファゴソームの形成に関わる5つの複合体
オートファゴソームの形成に必要な因子は多数存在しますが、大きく下記の5つの機能的なグループに分類できます。
Atgタンパク質群とその機能
| 酵母 | 哺乳類 | 機能 |
|---|---|---|
| Atg1 | ULK1, 2 | タンパク質リン酸化酵素で、Atg13, Atg17, Atg29と複合体を形成。 |
| Atg2 | ATG2A, ATG2B | Atg18と複合体を形成し、さらにAtg9と相互作用している。 |
| Atg3 | ATG3 | E2様酵素で、Atg8を特異的な基質とする。 |
| Atg4 | ATG4A, 4B, 4C, 4D | システインプロテアーゼであり、Atg8C末端の分解および脱PE化を担う。 |
| Atg5 | ATG5 | Atg12と複合体を形成し、隔離膜の伸長に関与。 |
| Atg6/Vps30 | Beclin-1 | Vps34 PI3K複合体のサブユニット。 |
| Atg7 | ATG7 | E1様酵素で、ATP依存的にAtg8/LC3, Atg12を活性化する。 |
| Atg8 | LC3, GABARAP, GATE-16 | ユビキチン様タンパク質で、PE(リン脂質)と結合体を形成。 |
| Atg9 | ATG9A(APG9L1) ATG9B(APG9L2) |
Atg2-Atg18複合体と相互作用する膜タンパク質。 |
| Atg10 | ATG10 | E2様酵素で、Atg12を特異的な基質とする。 |
| Atg11 | アダプタータンパク質としてAPI のCvt小胞への取り込み(酵母Cvt9)に関与。 | |
| Atg12 | ATG12 | ユビキチン様タンパク質であり、Atg5と結合体を形成し、Atg8/LC3とPEの結合(脂質化)を促進する。 |
| Atg13 | ATG13 | Atg1複合体のサブユニットで、キナーゼ活性に必要。通常高度にリン酸化されており、飢餓状態で脱リン酸化される。 |
| Atg14 | ATG14, ATG14L, BARKOR | Vps34 PI3K複合体のサブユニット。 |
| Atg15 | リパーゼ様タンパク質で、オートファジックボディの分解(酵母Aut5/Cvt17)に関与。 | |
| Atg16 | ATG16L1, ATG16L2 | Atg12-Atg5複合体と相互作用。欧米人ではクローン病との関連が示唆されている。 |
| Atg17 | Atg1複合体のサブユニット。 | |
| Atg18 | WIPI-1, 2 | PI3P結合タンパク質であり、Atg9/Atg2-Atg18複合体のサブユニット。 |
| Atg19 | Cvt経路におけるAPIの受容体(酵母) 。 | |
| Atg20 | Cvt経路におけるPI3P結合タンパク質(酵母)。 | |
| Atg21 | WIPI-1, 2 |
Cvt経路におけるPI3P結合タンパク質(酵母)。 |
| Atg22 | 液胞膜タンパク質で、オートファジックボディの分解に関与(酵母)。 | |
| Atg23 | Cvt小胞の形成に関与(酵母)。 | |
| Atg24 | Cvt経路およびペルオキシソーム分解(ペキソファジー)に関与。 | |
| Atg25 | ペルオキシソーム分解(ペキソファジー)に関与(酵母)。 | |
| Atg26 | ステロールグルコシルトランスフェラーゼでペキソファジーに関与(酵母)。 | |
| Atg27 | Cvt経路におけるPI3P結合タンパク質(酵母)。 | |
| Atg28 | ペルオキシソーム分解(ペキソファジー)に関与(酵母)。 | |
| Atg29 | Atg1複合体のサブユニット。Atg17, Atg31と複合体を形成。 | |
| Atg30 | ペルオキシソーム分解(ペキソファジー)に関与(酵母)。 | |
| Atg31 | 飢餓誘導性のオートファジーにおいて、Atg17-Atg29-Atg31複合体を形成。 | |
| Atg32 | BCL2L13 | ミトコンドリア外膜タンパク質で、マイトファジーに関与。マイトファジー誘導で、Atg8とAtg11と結合する。 |
| Atg33 | ミトコンドリア外膜タンパク質で、マイトファジーに関与。 | |
| Atg34 | αマンノシダーゼ輸送に関与 | |
| Atg35 | ペキソファジーにおいて、MIPA形成を制御している。 | |
| Atg36 | ペルオキシソームの膜上に局在するペキソファジー受容体。 | |
| Atg37 | ACBD5 | ペキソファジーの隔離膜形成に必要な、アシルCoA結合タンパク質。 |
| Atg38 | Atg14とVps34と相互作用し、Vps15-Vps34とVps30/Atg6-Atg14とのリンカーの役割を果たす。 | |
| Atg39 | 核膜の選択的オートファジーに関与。 | |
| Atg40 | 小胞体の選択的オートファジーに関与。 | |
| Atg41 | Atg9と相互作用し、Atg9の効率的なPAS形成に関与。 |
ユビキチン様因子Atg8の結合反応系
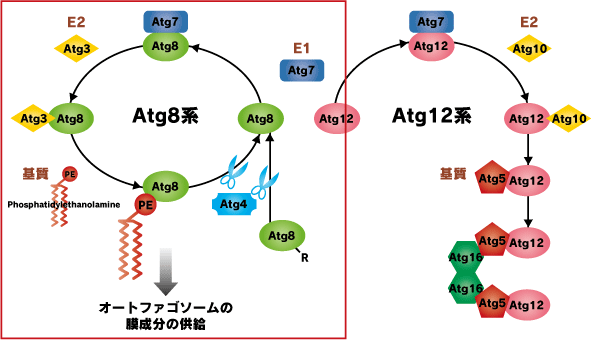
Atg8系:ユビキチン様タンパク質Atg8はC末のアルギニン残基をシステインプロテアーゼのAtg4によって分解された後、E1(Atg7)とE2(Atg3)に渡され、基質であるリン脂質(PE)の頭部に転移されます。このAtg8-PE結合体はオートファゴソームの膜成分の一部として機能しています。またAtg8-PEはAtg4によって脱PE化されることで、Atg8がリサイクルされます。なお、オートファジーにおけるE3様タンパク質はいまのところ見つかっていません。
ユビキチン様因子Atg12の結合反応系
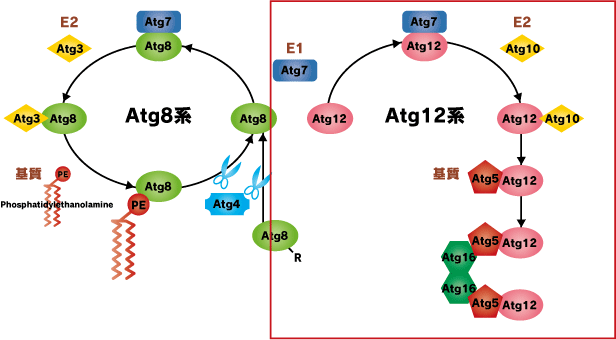
Atg12系:もう一つのユビキチン様タンパク質であるAtg12は他のユビキチン様タンパク質と異なってC末がグリシンであり、プロセシングを受けません。E1はAtg8と共通のAtg7です。E2であるAtg10に渡されたのち、基質のAtg5に転移されます。このAtg12-Atg5結合体はAtg16と複合体を形成します。Atg16は自己多量体化するため、Atg12-Atg5-Atg16結合体はより大きな複合体を形成します。この複合体の機能は不明ですが、酵母では前オートファゴソーム構造体であるPAS(pre-autophagosomal structure)への局在に必須であることが示されています。 またAtg16の哺乳類ホモログであるAtg16Lは、酵母Atg16とは異なり、そのC末にWDリピートドメインを持ちます。このWDリピートドメイン内の遺伝子変異とクローン病(炎症性腸炎)との関連に注目が集まっています。
Atg1タンパク質キナーゼ複合体
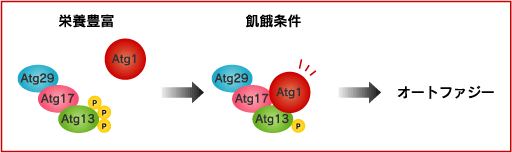
オートファジーの誘導はタンパク質キナーゼのTOR(target of rapamycin)の不活性化を介しています。栄養が豊富な環境においてTOR依存的に高リン酸化されている因子の一つにAtg13があります。このときAtg13はAtg1への結合能を失っているとともに、Atg1のキナーゼ活性は低く抑えられています。
一方、飢餓状態になるとTORが不活性化され、Atg13のリン酸化レベルが減少します。するとAtg13とAtg17がAtg1に結合し、Atg1はキナーゼ活性を発揮します。オートファジーの開始はこのAtg1のキナーゼ活性に依存していることが知られていますが、その詳細は不明です。同じ現象はTORの阻害剤のラパマイシンでも誘導できます。出芽酵母ではAtg17にAtg29が結合していることが判っています。
Vps34 PI3キナーゼ複合体
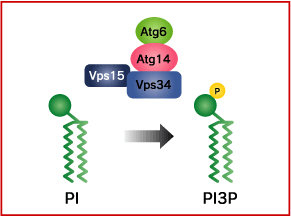 ホスファチジルイノシトール3-キナーゼ(PI3K)は、膜脂質のホスファチジルイノシトール(PI)をリン酸化して、ホスホイノシチド3-リン酸(PI3P)をつくります。オートファジーの進行においてはVps34と呼ばれるクラスIIIのPI3K活性が必須です。
ホスファチジルイノシトール3-キナーゼ(PI3K)は、膜脂質のホスファチジルイノシトール(PI)をリン酸化して、ホスホイノシチド3-リン酸(PI3P)をつくります。オートファジーの進行においてはVps34と呼ばれるクラスIIIのPI3K活性が必須です。
Vps34はVps15(プロテインキナーゼ)、Vps30/Atg6(哺乳類ではBeclin-1)、Atg14との複合体を形成しています。これらのサブユニットの一つでも欠損させるとオートファジーは誘導されません。またVps34の脂質キナーゼ活性はオートファジーに必須なことから、作り出されるPI3Pがオートファジーに何らかの役割を担っていると考えられています。またPI3Kの活性にはAtg14の存在が必要です。近年、Atg14の哺乳類ホモログとしてAtg14Lが同定されました。一方、Atg6の哺乳類ホモログであるBeclin-1は、各種の癌(乳、卵巣、前立腺)で欠損が報告され、Beclin-1ヘテロ欠損マウスでは癌が多発することが知られています。またBeclin-1 結合タンパク質のUVRAGにも癌と関連した遺伝子欠損が見つかっています。
Atg9とAtg2-Atg18複合体
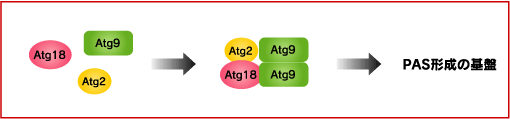
オートファジーが細胞内のどこで誘導されるかは不明ですが、酵母においてはAtgタンパク質が集中して集まる前オートファゴソーム構造体 (PAS) がその形成開始部位と考えられています。 ATG9遺伝子を欠損した出芽酵母では多くのAtgタンパク質がPAS局在を失うことから、Atg9はPAS形成の初期に何らかの機能をしていると考えられています。
PAS上のAtg9にはAtg2とAtg18の複合体が結合しています。Atg18はPI3Pと結合することが知られていますが、この複合体の機能は現在までのところ不明です。ATG18とATG2に変異をもつ酵母ではPASにAtg9が高度に蓄積することが示されています。一方、オートファゴソーム上にはAtg9は局在しないことから、PASからAtg9が離脱する仕組みが存在しているはずです。Atg2-Atg18複合体がその過程に関与しているのかもしれません。
増え続けるオートファジー関連因子
 各複合体の役割や複合体間の相互関係などまだまだ未解決な課題が残されていますが、最近ではAtg結合タンパク質を始めとするオートファジー関連因子が次々に同定されています。
各複合体の役割や複合体間の相互関係などまだまだ未解決な課題が残されていますが、最近ではAtg結合タンパク質を始めとするオートファジー関連因子が次々に同定されています。
UV抵抗性に関係するUVRAGはBeclin-1結合タンパク質として再注目され、PI3Kの活性化を介したオートファゴソームの形成に関与していることが判明しています。
Atg8(LC3)に相互作用するp62/a170/SQSTM1(p62)は、ERKやPKCを介したシグナル伝達の足場タンパク質ですが、そのC末端にユビキチン会合ドメインをもつことから、p62によるユビキチン・プロテアソーム分解系とオートファジーとのクロストークが示唆されています。 またオートファジーによる病原体除去においては、自然免疫における病原体認識に重要なToll-Like ReceptorやIFNγ誘導型のGTP結合タンパク質の一種であるLRGM/LRG-47が利用されていることがわかっています。
このようにオートファジーの研究を契機に生体現象の多様で新しい相互作用が見えてきました。
広がるオートファジーの世界
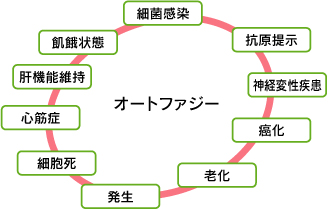 酵母で発見されたAtgタンパク質群は、粘菌、線虫、ハエ、動植物などで広く保存されていますが、 機能面ではそれぞれの種で高度に多様化していることが分かってきています。さらに最近では哺乳類のオートファジーは飢餓応答だけでなく、細菌感染防御、抗原提示、細胞死、発生、老化、そして癌化などの各種の疾患にも関連していることがあきらかになりつつあります。これらの生命現象を理解する上でも、オートファジーの研究はますます重要な意義を持っていると言えるでしょう。
酵母で発見されたAtgタンパク質群は、粘菌、線虫、ハエ、動植物などで広く保存されていますが、 機能面ではそれぞれの種で高度に多様化していることが分かってきています。さらに最近では哺乳類のオートファジーは飢餓応答だけでなく、細菌感染防御、抗原提示、細胞死、発生、老化、そして癌化などの各種の疾患にも関連していることがあきらかになりつつあります。これらの生命現象を理解する上でも、オートファジーの研究はますます重要な意義を持っていると言えるでしょう。




 LC3抗体
LC3抗体