製品使用例
「膵癌病理診断の残余検体を用いたオルガノイドの構築」
当記事は池澤賢治(大阪国際がんセンター 肝胆膵内科副部長・膵検診室長)、江川智哉(大阪国際がんセンター 研究所 がん創薬部 研究員)らとの共著論文1)の内容に基づいています。
1. 研究概要
膵癌は全癌腫のなかでも予後不良な癌であり、5年生存率は約10%程度と極めて低率である。適切な治療選択のために膵癌の病理診断は重要であり、中でも超音波内視鏡下穿刺吸引法 (endoscopic ultrasound-guided tissue acquisition ; EUS-FNA) は高い診断率と安全性から、膵癌診療において重要な病理診断法と位置付けられている。今回我々はEUS-FNA針洗浄液という本来残余と考えられる検体から膵癌由来オルガノイド樹立が可能であることを報告した。腫瘍由来オルガノイドは個別化治療、前臨床評価などに有用な研究なツールである。治療前の組織診検体量の確保が他臓器癌と比して困難な膵癌においては、膵癌由来オルガノイドの樹立を可能とする重要な選択肢の一つとなり得る。
2. 膵癌病理診断の際の針洗浄液による腫瘍由来オルガノイド樹立の意義
EUS-FNAは先端に超音波装置のついた内視鏡を経口的に挿入、胃あるいは十二指腸から膵腫瘍を超音波下に描出し、主に22ゲージ針で針生検を行う方法である。病理診断だけでなく、近年保険適応となった遺伝子診断(がん遺伝子パネル検査など)にも組織診検体は用いられるが、EUS-FNAでは十分な組織診検体量を確保するのが難しいケースもある。
腫瘍由来オルガノイドは生体組織に近い生物学的機能を保持するため、化学療法の治療効果予測、バイオバンクなど幅広い役割が期待される。しかし、膵癌EUS-FNA施行症例においては上述のように限られた量の組織診検体を病理診断・遺伝子診断に用いる必要があることから、オルガノイド樹立に用いることが出来る組織診検体は限られるのが現状である。
EUS-FNA穿刺針から採取された検体をシャーレに押し出す際には生理食塩水が用いられるが、今回我々は本来残余検体である針洗浄液を用いてオルガノイド樹立が可能であるかについて検討した。
3. 残余検体の調製
残余検体としてEUS-FNA穿刺針の生理食塩水洗浄液を遠心チューブに集め、氷上に10分間静置し、癌組織の小断片を自然落下沈査として回収した。PBSで沈査を洗い込みながら、なるべく赤血球を除去し、洗浄した沈査に2.5 mg/mL Liberase™ TH (Merck) および10 µg/mL DNase I (Merck)を添加し、37℃で5~15分間酵素処理した後、1 mLピペットチップを使ったピペッティングにより、細断化した。赤血球が多く残っている場合、1x RBC Lysis Buffer (pluriSelect) を用い、室温で5分間インキュベートし赤血球を溶解した。赤血球を除き、細断化した残渣はPBSで遠心洗浄後、適量の氷冷 Matrigel® (growth factor reduced, phenol red-free) (Corning) と混釈し、24ウェルプレート上にゲルドームとして播種した。今回、症例1から症例5までの残余検体を得た。
4. 膵癌オルガノイドの樹立
膵癌オルガノイドの培養に用いる培地はSeino2)らの報告に基づき調製した。概略するとAdvanced DMEM/F12 (Thermo Fisher Scientific) に1x GlutaMAX™ (Thermo Fisher Scientific)、10 mM HEPES (Thermo Fisher Scientific)、100 U/mL penicillin/streptomycin (Thermo Fisher Scientific)、 50 µg/mL primocin® (InvivoGen)、1x B-27™ Supplement (Thermo Fisher Scientific)、1.25 mM N-acetylcysteine (Merck)、10 nM gastrin (Merck)、5 µM A83–01 (TGF-β inhibitor) (Tocris Bioscience)、10 µM Y-27632 (FUJIFILM)にニッチ因子として10 % Afamin/Wnt3a CM (MBL)をはじめとする必要な成長因子類等を添加した完全培地を調製した。さらに正常細胞の混入を防ぐ目的で完全培地から、膵癌のドライバー遺伝子異常に対応するEGF、FGF2、IGF1を除去したKRAS変異体選択培地、Noggin、A83-01、Wnt3aを除去したSMAD4変異体選択培地を調製し、TP53変異体選択培地には3 µM Nutlin-3(MDM2阻害剤)(Cayman Chemical) を完全培地に添加したものを調製した。調製した各培地で培養したオルガノイドの直径が200 µmより大きくなったものが30%を超えるか、多数のオルガノイドが重なり合った状態になった時、オルガノイドをTrypLE™ Express Enzyme (Thermo Fisher Scientific) で細胞解離し、再びプレートに播種することで継代培養を行った。オルガノイドは5回以上の継代が成功した場合に、樹立成功とみなした。その結果、完全培地を用いて5症例のうち4症例(80%)からオルガノイドを樹立することに成功した(表1)。また、これらの症例では、KRAS変異体選択培地を使用してもオルガノイドを樹立することができた。症例2では、完全培地、KRAS変異体選択培地およびSMAD4変異体選択培地でオルガノイドの樹立に成功した(図1)。
| 培地 | ||||
|---|---|---|---|---|
| 症例 | 完全 | KRAS変異体選択 | TP53変異体選択 | SMAD4変異体選択 |
| 1 | 64日 | 106日 | ー | ー |
| 2 | 54日 | 54日 | ー | 63日 |
| 3 | ー | ー | ー | ー |
| 4 | 58日 | 71日 | ー | ー |
| 5 | 84日 | 61日 | ー | ー |
表1 . EUS-FNA穿刺針の洗浄液からのオルガノイドの樹立にかかった日数。5継代にわたって培養が維持されたものをオルガノイド樹立とした。樹立できなかったものについては「ー」で示した。
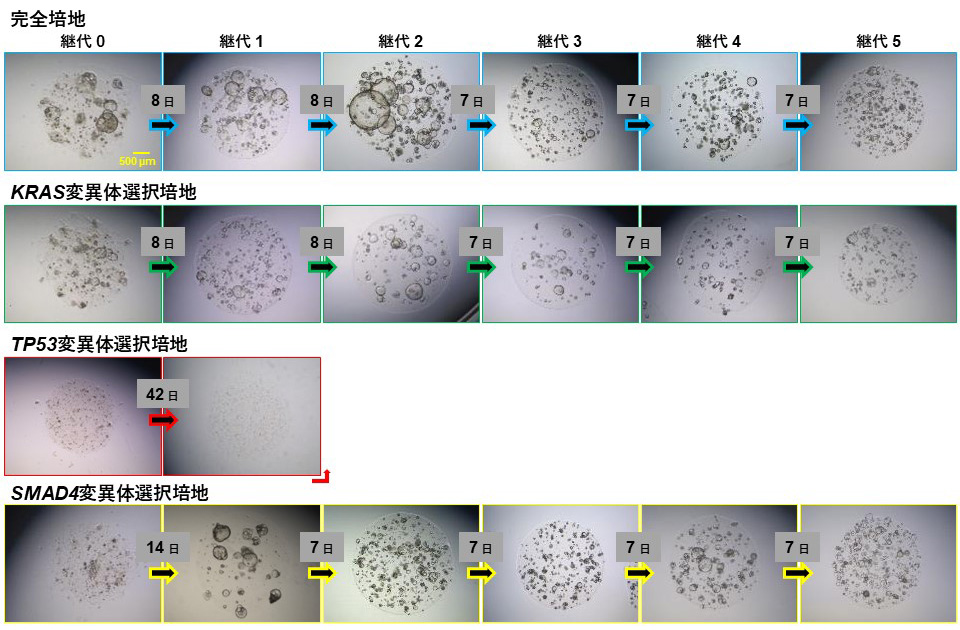
図1. 遺伝子変異に対応した選択培地でのオルガノイドの調製(症例2)。
完全培地、KRAS変異体選択培地、TP53変異体選択培地、SMAD4変異体選択培地におけるオルガノイドの光学顕微鏡像(参考文献1より引用)。
5. 患者由来オルガノイドの移植腫瘍とEUS-FNA腫瘍との病理組織比較
樹立した膵癌オルガノイド移植によるマウス移植腫瘍を作製するため(症例1および2)、オルガノイド約1,000 個を DMEM (Merck) 中に取り出し、氷冷Matrigel®と1:1の割合で混合し、NOD SCIDマウス (Charles River) の背中に皮下注射した。その後、生着・増大した移植腫瘍を取り出し、病理学的分析のため、10%ホルマリン中性緩衝液で固定後、パラフィン切片を作製し、ヘマトキシリン・エオジン(HE)染色を行った。マウス移植腫瘍とEUS-FNA腫瘍の病理組織像を比べると、症例1では局所的な核多形を伴う不規則な腺構造が見られ(図2a、図2b)、症例2では豊富な細胞内ムチンを含む乳頭構造が観察され(図2c、図2d)、マウス移植腫瘍が元の患者の癌組織の構造を保持していることを示した。
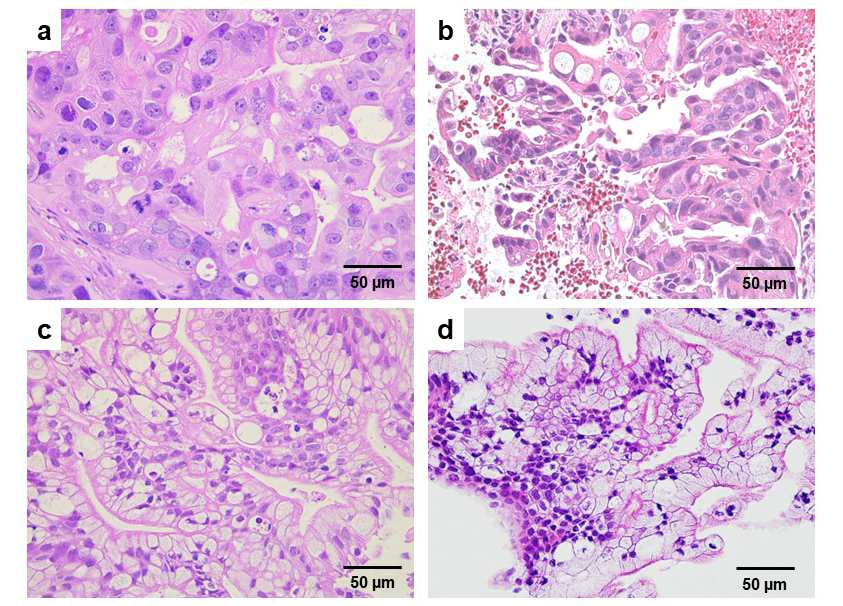
図2. 膵癌オルガノイド移植マウス腫瘍およびEUS-FNA腫瘍をHE染色した病理組織像。
a: 症例1のマウス腫瘍。b: 症例1のEUS-FNA腫瘍。ⅽ: 症例2のマウス腫瘍。d: 症例2のEUS-FNA腫瘍。
6. おわりに
腫瘍由来オルガノイドはおもに外科切除検体を用いて樹立が行われてきたが3)、近年では膵癌術前治療の重要性が報告され、本邦でも術前治療が広く行われるようになった4)。そのため、術前治療に伴う腫瘍縮小の影響を受けて、膵切除検体からのオルガノイド樹立が難しくなる可能性がある。またEUS-FNA組織診検体からの腫瘍由来オルガノイドは樹立可能と報告されているが5)、EUS-FNA組織診検体の量は限られる。今回我々の検討において、EUS-FNA針洗浄液での腫瘍由来オルガノイド樹立は技術的に可能であった。EUS-FNAでは治療開始前の検体が採取可能であること、EUS-FNA針洗浄液は本来残余検体であることから、本技術の有用性・汎用性は高いと考えられる。本検討ではオルガノイドは5回以上の継代が成功した場合に樹立成功と定義したため、樹立までの日数は54-106日と長期を要しており、この点は今後の検討課題と考えられる。
7. 参考文献
- Ikezawa K, Ekawa T, Ohkawa K, Tahara H, et al. Establishment of organoids using residual samples from saline flushes during endoscopic ultrasound-guided fine-needle aspiration in patients with pancreatic cancer. Endosc Int Open. 2022;10(1):E82-E87.
- Seino T, Kawasaki S, Shimokawa M, et al. Human pancreatic tumor organoids reveal loss of stem cell niche factor dependence during disease progression. Cell Stem Cell. 2018;22(3):454–467.
- Boj SF, Hwang CI, Baker LA, et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 2015;160(1-2):324-338.
- Springfeld C, Ferrone CR, Katz MHG, et al. Neoadjuvant therapy for pancreatic cancer. Nat Rev Clin Oncol. 2023;20(5):318-337.
- Tiriac H, Bucobo JC, Tzimas D, et al. Successful creation of pancreatic cancer organoids by means of EUS-guided fine-needle biopsy sampling for personalized cancer treatment. Gastrointest Endosc. 2018;87(6):1474-1480.
Profile
関連製品
- Afamin/Wnt3a CM
無血清培地における安定的なオルガノイド培養の実現に。 - Afamin/Wnt3a CM 無償サンプル申請フォーム

