製品使用例
「ヒトiPS細胞を用いた分枝形態形成を行う尿管芽オルガノイドの作製と再生」
概要
末期慢性腎不全は有効な治療法が少なく、本邦においても医療経済を圧迫していることなどから、iPS細胞(induced pluripotent stem cell、人工多能性幹細胞)を用いた腎疾患に対する再生医療の開発が解決策の一つとして期待されている。実験動物を用いた腎発生機構の解明や腎前駆細胞の性状解析が徐々に進展し、それらの知見に基づいてヒト多能性幹細胞からネフロンオルガノイドを作製することが可能となっている。さらに、腎前駆組織の一つである尿管芽構造を分化誘導する多くの試みもなされているが、その特徴である分枝形態形成がほとんど認められないため、その課題を解決することが急務であった。そこで、著者らは、過去に発表した方法を改良することにより、ヒトiPS細胞から分枝形態形成を繰り返す尿管芽オルガノイドの作製に成功した。さらに、作製した尿管芽オルガノイドの構成細胞から選択的に尿管芽先端(tip)細胞を誘導し、拡大培養したtip細胞から尿管芽オルガノイドを再生する方法を開発した。今後、開発した方法を患者由来iPS細胞をはじめとする様々なヒトiPS細胞株に応用することにより、尿管芽の分枝形態形成機序の解明や疾患モデル作製、治療薬探索などの臨床応用を目指した研究への発展が期待される。
1. はじめに
腎臓は約30種類の細胞で構成される複雑な臓器であり、糸球体と尿細管から成る腎臓の機能単位であるネフロンが集合管につながる一連の上皮組織を構築している。その生理学的機能は、体液の恒常性の維持、尿素など老廃物の排出、エリスロポエチン分泌による骨髄での赤血球産生の維持、レニン産生による血圧の調節、ビタミンD活性化による血中のカルシウム濃度の制御など多岐に渡る1)。現在までのところ、腎疾患に対する有効な治療法が確立されていないことから、乳幼児期や高齢期に関わらず、慢性腎不全における腎機能の代替としての透析療法が主な治療選択肢となっている。また、末期慢性腎不全の根本的治療である腎移植は深刻なドナー不足の問題を抱えており、免疫学的な適合性の問題も相まって、その実施数は本邦において年間1,700例程度に留まっている。
それらの問題を解決するために、ヒトの全身のほぼすべての細胞に分化する多能性を有する幹細胞であるES細胞(embryonic stem cell、胚性幹細胞)2-4)やiPS細胞(induced pluripotent stem cell、人工多能性幹細胞)5-7)を用いた腎再生医療の実現が期待されている。
本稿では、ヒト多能性幹細胞から集合管に分化しうる前駆組織である尿管芽への分化誘導研究における著者らの最新の知見を要約し、集合管を中心として特定細胞種の選択的分化誘導を活用した疾患モデル作製研究への応用など、腎疾患に対する再生医療開発に向けた今後の展望について概説する。
2. 分枝形態形成を繰り返す尿管芽オルガノイドの作製
腎集合管は、主に水分を再吸収することによって尿を濃縮する役割を担っており、胎生期の腎前駆組織である尿管芽が分枝を繰り返すことにより分化し、形成される8)。尿管芽は先端部(tip)細胞と幹部(trunk)細胞で構成され、tip細胞は増殖を繰り返すことで新しいtip細胞とtrunk細胞を作り、trunk細胞が集合管細胞へと分化する9)。つまり、尿管芽組織における分枝形成の過程において、tip細胞が組織幹細胞の役割を担うと考えられている。国内外のグループに先駆け、著者らはすでに腎発生過程を段階的に模倣することによってヒトiPS細胞から尿管芽構造を選択的に作製する独自の方法を開発している10)。しかし、著者らが開発した尿管芽構造は、その特徴である分枝がほとんど認められないため、その課題を解決することが急務であった。
分枝形態形成は、胚発生において、腎臓だけでなく様々な器官形成に必要なプロセスである。間葉細胞と上皮細胞の相互作用が分枝形態形成を促すことが普遍的に知られているが、各器官は少しずつ異なるメカニズムを有しているため、それぞれが特徴的な分枝パターンを呈する11)。血管は単一の細胞が伸長し、二次的に内腔が形成されることで分枝形態形成が起こるのに対し、尿管芽では常に内腔が存在しながら分枝が繰り返される12)。これらの知見から、分枝する尿管芽の特徴的な点として内腔を有することが考えられるが、著者らが作製した尿管芽構造には内腔が認められなかった。
多能性幹細胞の自己組織化を促すことで組織構築を行う浮遊培養法が確立され、組織構築には連続上皮構造の形成が重要なプロセスであることが知られている13)。また、低濃度のマトリゲルを含む培養液を用いて浮遊培養を行うことにより、連続上皮組織の形成が促されることも報告された14)。そこで、中腎管が尿管芽発生過程で最も早期に形成される連続上皮組織であること9)に着目し、ヒトiPS細胞由来の中腎管上皮から成る細胞塊を低濃度マトリゲルが含まれた培養液を用いて浮遊培養することによって、管腔および頂底極性を有する単層連続上皮組織の尿管芽オルガノイドを作製することに成功した(図1A, B)。さらに、作製した尿管芽オルガノイドから機械的に切離したtip細胞から、管腔および頂底極性を有する単層連続上皮組織の尿管芽オルガノイドを再生することができ、その再生プロセスは3回程度繰り返すことが可能であった(図1C)。したがって、これまでに報告のない、生体内の尿管芽と同様に幾度も繰り返される分枝形態形成と管腔構造を有する尿管芽オルガノイドを作製することが可能となった。
次に、著者らはシングルセルRNAシークエンス解析を行うことにより、尿管芽オルガノイドの特性を詳細に検証することを試みた。まず、UMAP(Uniform Manifold Approximation and Projection)を用いた次元削減によって2次元的に可視化し、同様の遺伝子発現プロファイルを有する細胞をクラスタリングしたところ、尿管芽オルガノイドに含まれる細胞は8つのクラスターに分類可能であることが分かった(図2A)。また、尿管芽オルガノイドには、傍尿管芽間葉細胞や神経細胞などのオフターゲット細胞が含まれていたが、大部分が尿管芽系譜細胞で構成されており、tip細胞およびtrunk細胞クラスターを可視化することができた(図2B)。そこで、それらのクラスター間における遺伝子発現比較解析を行ったところ、tip細胞は細胞増殖マーカーであるMKI67およびTOP2Aを高発現し、幹細胞の性質を有することが考えられた。一方で、VEGFAおよびNOTCH1を含む低酸素誘導因子(HIF1α)によって誘導される遺伝子の発現がtrunk細胞で亢進していることも分かった。腎発生において分枝する尿管芽に沿って血管網が構築されるため15)、trunk細胞から分泌されるVEGFAが血管細胞の遊走を調節している可能性が示唆された。さらに、尿管芽系譜細胞を疑似時間軸に沿って並べたところ、幹細胞であるtip細胞からtrunk細胞への分化過程を2次元的に可視化することができ(図2C)、その分化過程における遺伝子発現変化が生体内のものと同様であることも分かった(図2D)。これらの結果から、ヒトiPS細胞から作製した分枝形態形成を行う尿管芽オルガノイドは、腎発生過程を模倣すると考えられた。
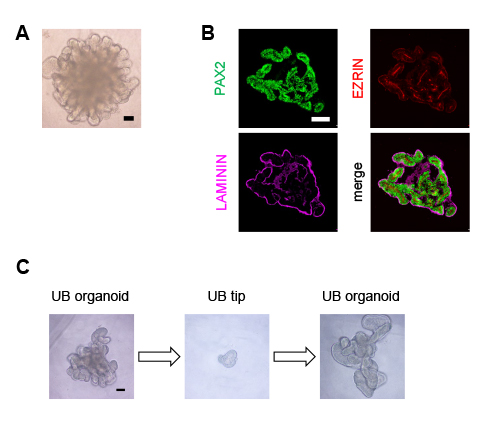
図1. ヒトiPS細胞から分枝形態形成を行う尿管芽オルガノイドの作製
(A) ヒトiPS細胞由来尿管芽オルガノイドの明視野像。 (B) ヒトiPS細胞由来尿管芽オルガノイドの免疫染色像。PAX2: 尿管芽細胞マーカー、EZRIN: 頂端マーカー、LAMININ: 基底マーカー。 (C) 尿管芽tipから尿管芽オルガノイドの再生。左:ヒトiPS細胞から分化誘導した尿管芽オルガノイド、中央:切離した尿管芽tip、右:再生した尿管芽オルガノイド。スケールバー:100 µm。
(文献25より改変し引用)
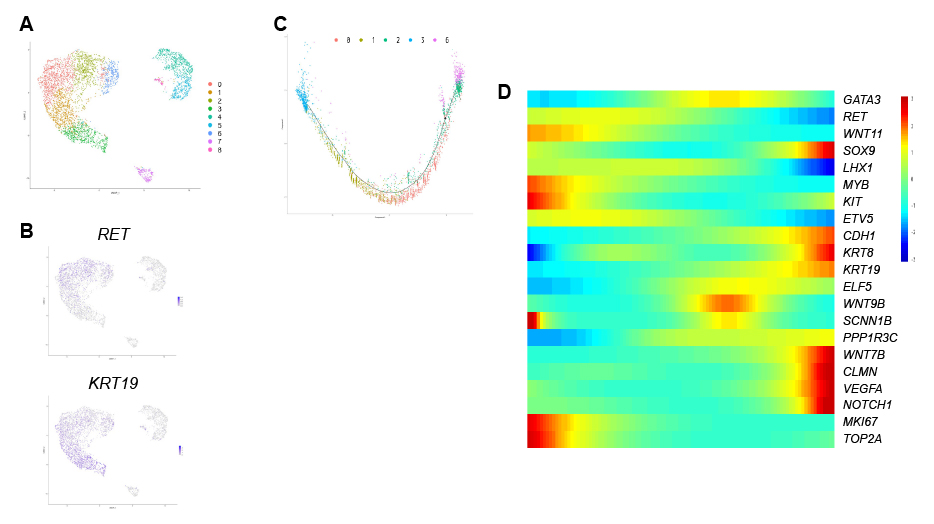
図2. シングルセルRNAシークエンス解析による尿管芽オルガノイドの評価
(A) UMAPプロット。クラスター0, 2, 6: 尿管芽tip細胞、クラスター1, 3: 尿管芽trunk細胞、クラスター4, 5, 7, 8: オフターゲット細胞。(B) 尿管芽tipおよびtrunkマーカーの発現パターン。紫色が濃いほど強く発現していることを示す。RET: tipマーカー、KRT19: trunkマーカー。(C) 尿管芽系譜細胞における疑似時間解析。tip細胞(右)からtrunk細胞(左)が疑似時間軸に沿って並んでいる。(D) 疑似時間軸に沿った尿管芽系譜マーカーの発現変動。赤色が濃いほど強い発現を示し、tip細胞(左)からtrunk細胞(右)に分化する過程でそれぞれの遺伝子発現が変動している。
(文献25より改変し引用)
3. 尿管芽tip細胞のモニタリングと拡大培養法の開発
マウス腎発生において、超低密度リポタンパク質受容体(very low-density lipoprotein receptor; Vldlr)は、尿管芽tip領域のみでの発現が報告されている16)。そこで著者らは、独自の方法で作製される尿管芽オルガノイドにおいてVLDLRが発現し、DiIで標識したVLDLがVLDLRを介して細胞内に取り込まれることを確認した(図3A)。そして、フローサイトメーターを用いてDiI陽性および陰性の細胞を分取し、遺伝子発現解析によりDiI陽性細胞がtip細胞であることを明らかにした(図3B)。これらの結果から、DiIで標識したVLDLの取り込みによりtip細胞をモニタリングする方法の開発に成功した。
尿管芽tip領域では、細胞の形状や密度を感知して細胞増殖を制御する転写活性化因子であるYAP/TAZが細胞質に局在していることが報告されている17)。また、YAP/TAZの局在は細胞外基質の硬さと密接に関連している。そこで、単一の尿管芽構成細胞をマトリゲルから成る軟らかいハイドロゲル上に播種したところ、尿管芽構成細胞はコロニーを形成し、tip細胞マーカーであるRETの発現が維持されることが分かった。また、YAP/TAZの細胞質への移行を促進する化合物であるThiazovivinを用いることで、DiIで標識したVLDLを取り込まないtrunk細胞がDiIで標識したVLDLを取り込むtip細胞へと分化することを見出した。そして、それらの方法を組み合わせることによって、ほぼすべての尿管芽構成細胞からDiIで標識したVLDLを取り込むtip細胞コロニーを作製する方法の確立に成功した(図3C, D)。
上述の通り、著者らは分枝した尿管芽オルガノイドのtip部分を機械的に切離し、そこから分枝する尿管芽オルガノイドの再生に成功している。そこで、その培養法を踏襲し、tip細胞コロニーから尿管芽オルガノイドを再生することを試みたが、分枝形態形成を行う変化は認められなかった。
腸オルガノイド再生過程において、一過性のYAP1活性化によって惹起されるNOTCHシグナルが重要であることが知られている18)。尿管芽tip細胞コロニーはYAP/TAZを不活性化することで作製されることから、著者らはYAP/TAZの活性化が尿管芽オルガノイドの再生にも有効ではないかと考えた。そこで、GSK3β阻害によってWnt/β-cateninシグナルを活性化する化合物であるCHIR99021の代わりにAfamin/Wnt3a conditioned mediumを用いたところ、YAP/TAZが活性化され、tip細胞コロニーから尿管芽オルガノイドの再生が可能となることが分かった(図3E, F)。したがって、尿管芽オルガノイドから機械的に切離することなく、選択的に誘導し、拡大培養したtip細胞から尿管芽オルガノイドを再生する独自の培養法を開発することに成功した。
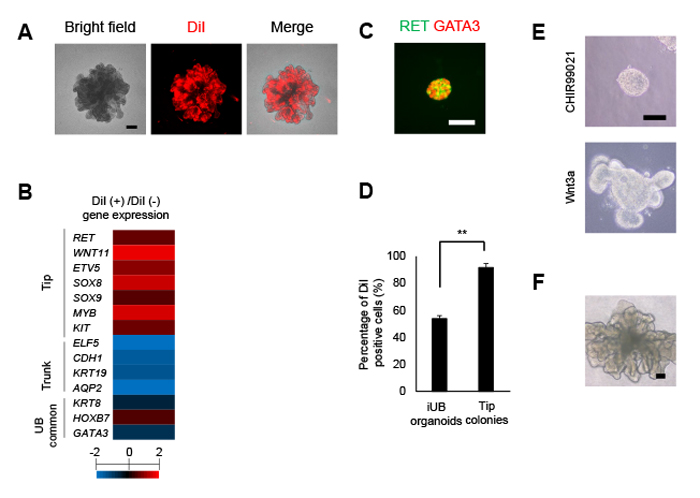
図3. 尿管芽tip細胞のモニタリングと拡大培養法の開発
(A) 尿管芽オルガノイドへのDiI標識されたVLDLの取り込み。(B) RNAシークエンス解析によるDiI陽性および陰性細胞の遺伝子発現比較。DiI陽性細胞はtip細胞マーカーを強く発現している。(C) tip細胞コロニーの免疫染色像。RET: 尿管芽tipマーカー、GATA3: 尿管芽マーカー。 (D) DiIで標識されるVLDLを取り込む細胞の割合の比較。9割以上の効率で、DiIで標識されるVLDLが取り込まれるtip細胞を誘導できている。(E) tip細胞コロニーから尿管芽オルガノイドの再生。CHIR99021: GSK3β阻害剤、Wnt3a: Afamin/Wnt3a conditioned medium。Afamin/Wnt3a conditioned mediumを用いることで発芽構造の形成を認める。 (F) tip細胞コロニーから再生された尿管芽オルガノイドの明視野像。スケールバー: 100 µm。
(文献25より改変し引用)
4. 尿管芽オルガノイド技術を用いた腎疾患モデルの開発
先天性腎尿路異常(Congenital Anomalies of the Kidney and Urinary Tract; CAKUT)は、腎尿路におけるさまざまな形態形成異常、奇形、機能異常を伴う病態であり、本邦における透析療法の必要な小児の原疾患の約7割を占めると推定されている。CAKUTの大半は尿管芽の形成が障害を受けることによって引き起こされ、尿管芽発生に必須の転写因子であるHNF1βの変異は嚢胞形成を主体とする多嚢胞性異形成腎(Multicystic Dysplastic Kidney; MCDK)の原因となる。尿管芽の分枝形態形成において、HNF1βは細胞‐細胞間の結合や上皮組織の極性形成を担うと考えられている19)。著者らは、内腔および上皮の極性を有する尿管芽オルガノイドの作製過程においてHNF1β遺伝子の発現を抑制することによって、新規のin vitro腎疾患モデルが作製可能ではないかと考えた。そこで、CRISPR/Cas9システムによる遺伝子編集技術を用いてHNF1β遺伝子ヘテロ変異(HNF1β+/-)を有するヒトiPS細胞株を樹立し、尿管芽オルガノイドへの分化誘導を行った。その結果、HNF1β遺伝子ヘテロ変異を有する尿管芽オルガノイドは正常コントロール株に比べ、尿管芽の発芽が明らかに減少することが分かった(図4A)。さらに、HNF1β遺伝子ヘテロ変異を有する尿管芽オルガノイドでは、頂端マーカー発現が遺伝子およびタンパク質レベルで有意に低下し(図4B)、MCDKモデルマウスにおける知見と同様に上皮細胞の頂底極性が失われる傾向が明らかとなった。これらの結果から、著者らの尿管芽オルガノイド技術がCAKUTの病態再現に有用であることが示唆された。
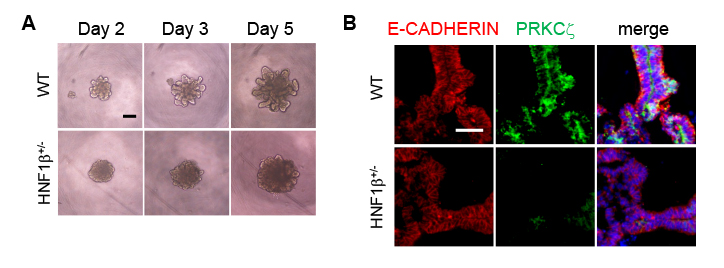
図4. ヒトiPS細胞由来尿管芽オルガノイド技術を用いた疾患モデルの作製
(A) 尿管芽オルガノイドの形態写真。WT: 正常コントロールiPS細胞、HNF1β+/-: HNF1β遺伝子ヘテロ変異を有するiPS細胞。HNF1β遺伝子変異を有するiPS細胞由来尿管芽オルガノイドは発芽する尿管芽が少ない。(B) 上皮極性マーカー発現。E-CADHERIN: 上皮細胞マーカー、PRKCζ: 頂端マーカー。HNF1β遺伝子変異を有するiPS細胞由来尿管芽オルガノイドでは頂端マーカー発現が減少している。スケールバー: 100 µm。
(文献25より改変し引用)
5. おわりに
現在までのところ、ヒト多能性幹細胞から尿管芽を分化誘導する方法はいくつか報告されているが20-23)、それらに比べ著者らが確立した尿管芽オルガノイド作製法はいくつかの利点を有している。まず、著者らの方法では尿管芽が派生する中腎管の分化誘導効率が70%以上であり、比較的簡便なピペット操作により目的外細胞を除去し中腎管細胞を濃縮できる。よって、他の方法において必須であるフローサイトメーターを用いた中腎管細胞の選別が不要であり、高い細胞生存率を保ったまま尿管芽細胞への分化誘導が可能である。さらに、著者らの方法は尿管芽発生過程を段階的かつより正確に模倣しているため、著者らのヒトiPS細胞由来尿管芽系譜細胞を用いる疾患モデルは、各発生段階における異常を容易に検出可能であると期待される。また、シングルセルRNAシークエンス解析で示された通り、著者らの尿管芽オルガノイドは生体内と同様のtip細胞からtrunk細胞への分化過程を再現しているため、分枝形態形成のメカニズム解明などヒト腎発生学の進展への貢献も可能である。
しかしながら、ヒト多能性幹細胞から尿管芽を経て腎集合管を再生するためには、集合管の成熟化をはじめとする多くの課題が依然として残っている。ヒト胚発生においては妊娠4週で尿管芽が形成され、妊娠15週付近まで分枝形態形成が繰り返された後に集合管の成熟化が認められるが9, 24)、ヒトiPS細胞から作製される尿管芽オルガノイドは分枝形態形成によってサイズが大きくなることから、in vitroで3週間以上培養することが困難である。特に、嚢胞性腎疾患である常染色体優性多発性嚢胞腎(ADPKD)や常染色体劣性多発性嚢胞腎(ARPKD)では、分枝形態形成が進行することで形成される集合管から嚢胞形成が起こるため、成熟集合管の作製はそれらの疾患モデルの開発に必須である。今後は、本稿で述べた技術を発展させることで、一日も早く多能性幹細胞から成熟集合管細胞を分化誘導する新しい培養技術が確立され、疾患モデル作製研究やそれらを用いた創薬スクリーニングが可能となることが望まれる。
(謝辞)
著者らの研究は、日本学術振興会(JSPS)科研費基盤研究C(19K08703)、日本医療研究開発機構(AMED)の再生医療実現拠点ネットワークプログラム「技術開発個別課題」、「iPS細胞研究中核拠点」、「疾患特異的iPS細胞の利活用促進・難病研究加速プログラム」により、助成を受けたものである。
文献
- Gekle, M. Exp Gerontol 87 (Pt B), 153-155, 2017.
- Evans, M.J., and Kaufman M.H. Nature 292, 154-156, 1981.
- Martin, GR. Proc Natl Acad Sci U S A 78, 7634–7638, 1981.
- Thomson, J.A., et al. Science 282, 1145–1147, 1998.
- Takahashi, K., and Yamanaka, S. Cell 126, 663–676, 2006.
- Takahashi, K., et al. Cell 131, 861–872, 2007.
- Yu, J., et al. Science 318, 1917–1920, 2007.
- Costantini, F., and Kopan, R. Dev Cell 18(5), 698-712, 2010.
- Shakya, R., et al. Dev Cell 8(1), 65-74, 2005.
- Mae, S.I., et al. Biochem Biophys Res Commun 495, 954-961, 2018.
- Davies, J.A. Bioessays 24(10), 937-948, 2002.
- Meyer, T.N., et al. Dev Biol 275(1), 44-67, 2004.
- Eiraku, M., et al. Nature 472(7341), 51-56, 2011.
- Koehle, K.R., et al. Nature 500(7461), 217-221, 2013.
- Munro, D.A.D., et al. Sci Rep 7, 3273, 2017.
- Rutledge, E.A., et al. Development 144(17), 3177-3188, 2017.
- Reginensi, A., et al. Nat Commun 7, 12309, 2016.
- Serra, D., et al. Nature 569(7754), 66-72, 2019.
- Desgrange, A., et al. Development 144(24), 4704-4719, 2017.
- Xia, Y., et al. Nat Cell Biol 15, 1507-1515, 2013.
- Taguchi, A., and Nishinakamura, R. Cell Stem Cell 21, 730-746 e736, 2017.
- Hariharan, K., et al. Methods Mol Biol 1926, 103-115, 2019.
- Tan, Z., et al. Cells 9(2), 329, 2020.
- Lindstrom, N.O., et al. J Am Soc Nephrol 29, 785-805, 2018.
- Mae, S.I., et al. Cell Reports 32(4), 107963, 2020.
Profile
関連製品
- Afamin/Wnt3a CM
無血清培地における安定的なオルガノイド培養の実現に。 - Afamin/Wnt3a CM 無償サンプル申請フォーム

