製品使用例
「ダイレクトリプログラミングによる誘導腸前駆細胞の作製」
1. はじめに
腸は、栄養素の吸収や水分の吸収など、外部から物質を取り込む機能を持った臓器である。そのため、腸の内腔は常に感染源にさらされており、腸上皮細胞は感染源からの感染を防ぐバリア機能の役目も持つ。こうした腸上皮細胞のバリア機能が崩壊すると炎症性腸疾患のような重篤な疾患が引き起こされるが、炎症性腸疾患の発症機序には未だ不明な点が多い。そのため、発症メカニズムの解明や治療法の開発が急務であり、腸上皮細胞の性質をもった細胞を用いてin vitroで網羅的に解析することが望まれていた。そうした中、2009年に腸の幹細胞をin vitroで大量に長期間維持できる腸上皮オルガノイド培養系が確立された。腸上皮オルガノイドは、生体内とよく似た組織構造を示し、腸の幹細胞や分化した細胞も含んでいた。このオルガノイド培養系を起点とし、腸組織由来の細胞だけではなく、胚性幹細胞(embryonic stem cell:ES細胞)や人工多能性幹細胞(induced pluripotent stem cell:iPS細胞)からも腸上皮オルガノイドを作製することができるようになった。さらに近年、筆者らは、細胞を未分化な状態を経ずに目的の細胞へと分化転換させるダイレクトリプログラミング法を用いて、マウス胎仔由来線維芽細胞にHnf4α、Foxa3、Gata6、Cdx2を組み合わせて導入することで胎仔腸由来の前駆細胞と同様の性質を持つ誘導腸前駆細胞の作製に成功した。誘導腸前駆細胞は球状のオルガノイド(spherical organoid:SO)を形成し、腸幹細胞の性質をもつ成体型のオルガノイド(budding organoid:BO)へと成長した。誘導腸前駆細胞から成長した誘導腸幹細胞は、生体内と同様に4種類の腸上皮細胞に分化することが可能であり、自己複製能も有していた。また、これらのオルガノイドを大腸炎モデルマウスに移植すると、小腸あるいは大腸組織を再構築することができた。このように誘導腸前駆細胞は、腸上皮オルガノイド作製の新たな材料として、腸の疾患に対する移植医療や薬剤の開発研究への貢献が期待される。
2. 腸上皮オルガノイドの作製
成体の哺乳類の腸上皮組織は陰窩(crypt)と絨毛(villus)の2つのドメインで構成されている。cryptの底部には、自己複製能を有する腸幹細胞(intestinal stem cell:ISC)が存在し、パネート細胞、吸収上皮細胞、内分泌細胞、杯細胞に分化できる1)。近年、ISCを培養下で維持する方法が確立され、腸の研究は大きく発展している2)。ISCをマトリゲルに包埋し、ISCの維持に必要な基本組成培地中で三次元培養を行うと生体内と同様にcryptとvillusの構造を持つ三次元組織構造体(オルガノイド)を形成する。このISC由来のcrypt様構造(Crypt-like domain:CLD)を有する成体型のオルガノイド(budding organoid:BO)は、培養下で長期間維持することが可能である。さらに、BOを大腸炎モデルマウスの大腸に移植すると、大腸組織中でcrypt-villus構造を有する小腸様組織を再構築する3)(図1)。
胎仔の腸は、高い増殖能を持つ腸前駆細胞(fetal intestine - derived progenitor cell:FIPC)を含んでいるが機能的に分化した細胞は少ない4)。また、cryptのない組織構造で形成されている。培養下においても、FIPCをマトリゲルに包埋し、ISCの維持に必要な基本組成にWnt3a(Afamin/Wnt3aなど)を含む培地中で培養を行うとCLDを持たない球状のオルガノイド(spherical organoid:SO)を形成する。SOは、Afamin/Wnt3aなどの外来性のWnt刺激によってBOへと誘導することが可能であるが、継代の途中で外来性のWnt刺激を除くことでBOへの成長が促進される。さらに、SOを大腸炎モデルマウスに移植すると、障害をうけた大腸組織を再構築できる4)(図1)。
このように、生体の組織由来の腸上皮オルガノイドは生体内と同様の性質を有したまま培養が可能であり、腸の疾患研究や移植医療に有用であると考えられる。一方、腸のオルガノイドの材料となる腸の組織片を成人のドナーや胎児から採取することは難しい。
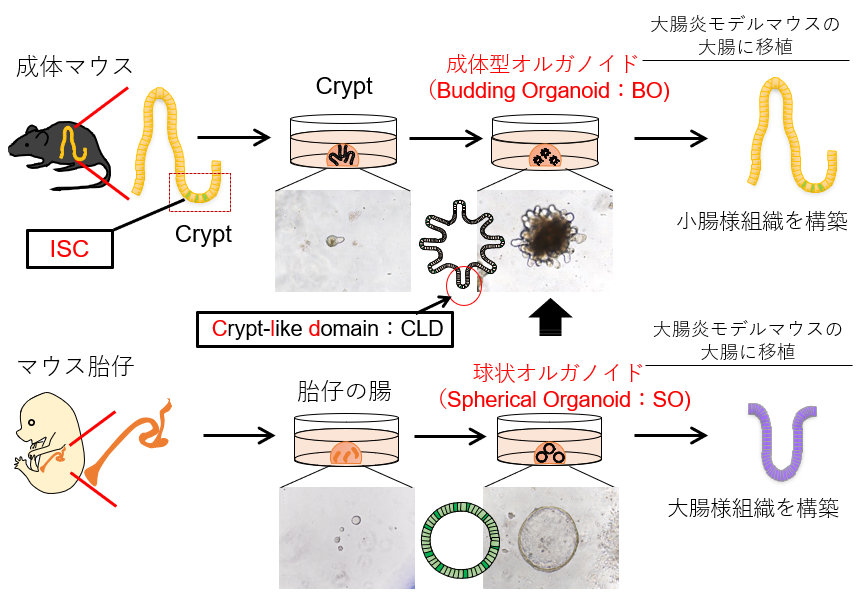
図1. 成体マウスの腸のcryptを三次元培養すると、Crypt-like domain(CLD)を有する成体型オルガノイド(BO)を形成する。BOは大腸炎モデルマウスの大腸に移植すると、小腸様組織を構築する。
マウスの胎仔の腸を三次元培養すると、球状のオルガノイド(SO)が形成され、大腸炎モデルマウスの大腸中で大腸組織を再構築できる。SOは、培養環境を変えることによってBOへと成長できる。
3. 細胞のリプログラミング技術を用いた腸上皮オルガノイドの作製
腸の組織由来のオルガノイドの代わりとして、近年、多能性幹細胞由来の腸のオルガノイドが広く利用されている。多能性幹細胞から作製する場合は、腸の上皮細胞以外の間葉系の細胞も同時に作製することが可能であり、実際の腸組織と似た構造体を作製できるという利点がある5)。しかしながら、多能性幹細胞から腸の細胞へと分化誘導するためには、複雑な工程を経なければならず、作製に時間もかかる。さらに、未分化な細胞が残存していた場合の腫瘍形成のリスクがある。
これらの問題を解決する方法として、ダイレクトリプログラミングという手法が注目されている(図2)。ダイレクトリプログラミングとは、未分化な状態を経ずに、分化した細胞を目的の細胞へと分化転換させる手法であり、この方法を用いて様々な種類の分化した細胞や前駆細胞を作製できるようになっている。筆者らの研究室でもこの方法を利用してマウス肝細胞様細胞(induced Hepatocyte-like cell:iHep細胞)およびヒト肝前駆細胞を誘導することに成功している6, 7)。しかしながら、この方法を用いてFIPCやISCを作製できるかどうかは不明であった。筆者らは、ダイレクトリプログラミングによって誘導腸前駆細胞(induced fetal intestine-derived progenitor cell:iFIPC)や誘導腸幹細胞(induced intestinal stem cell:iISC)を作製できれば、生体の腸や多能性幹細胞から誘導した腸幹細胞に代わる新たな材料になると考え、FIPCを誘導する因子を同定し、マウス線維芽細胞からiFIPCおよびiISCを誘導した8)。
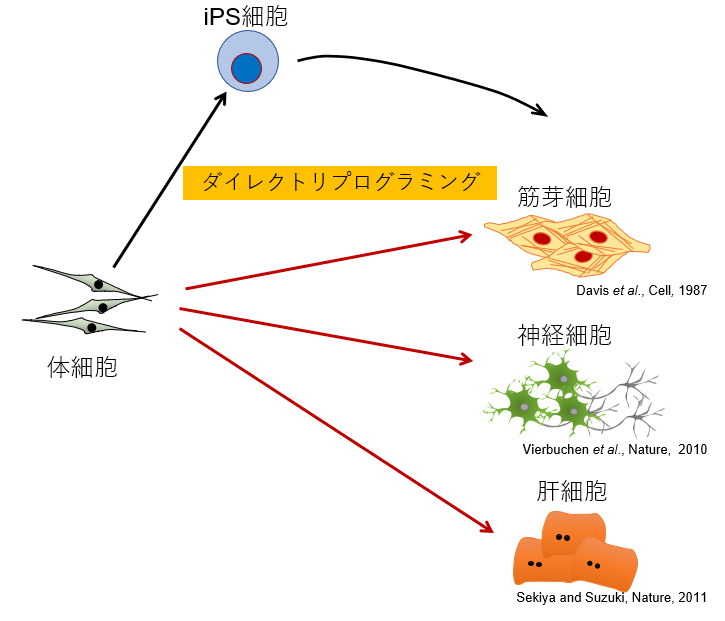
図2. ダイレクトリプログラミングは、体細胞に組織特異的な転写因子を導入することで、iPS細胞のような未分化な状態を経ずに目的の細胞へと誘導する手法である。
4. マウス胎仔線維芽細胞由来iFIPCの作製
筆者らは以前の研究で、マウス胎仔由来線維芽細胞(MEF)にHnf4αとFoxa3を導入してiHep細胞を誘導することに成功している6)。興味深いことに、iHep細胞誘導に用いた転写因子は腸の上皮細胞でも発現しており、また、網羅的遺伝子発現解析の結果、iHep細胞では、いくつかの腸特異的な遺伝子の発現が確認された。そこで筆者らは、ISCのマーカーであるLgr5の発現を可視化できるマウス(Lgr5-EGFP-ires-CreERT2)由来のMEFにHnf4αとFoxa3を強制発現させ、腸幹細胞の維持に必要な基本組成培地にAfamin/Wnt3a、CHIR99021(WCENR)を添加して三次元培養を行った。その結果、ごく少数のSOは形成されたが、BOは形成されず、Lgr5を発現するオルガノイドも観察されなかった。このことから、iFIPCへのダイレクトリプログラミングにはiHep細胞誘導因子だけでは不十分であり、転写因子の追加が必要であると考えられた。そこで筆者らは、腸で高発現し、腸の形態形成に必要な転写因子であるGata6とCdx2を追加してiFIPCの誘導を行った。Hnf4αとFoxa3にGata6とCdx2を加えた組み合わせをMEFに導入し三次元培養を行うと、胎生13.5日のマウスの腸を単離して培養した時と同様にSOとBOが形成され、これらはLgr5陽性細胞を含んでいた(図3)。また、FIPC由来のSO同様に、4つの転写因子を導入して形成されたSOにおいても継代を行い、外来性のWnt刺激を除くことによってBOへと成長した。
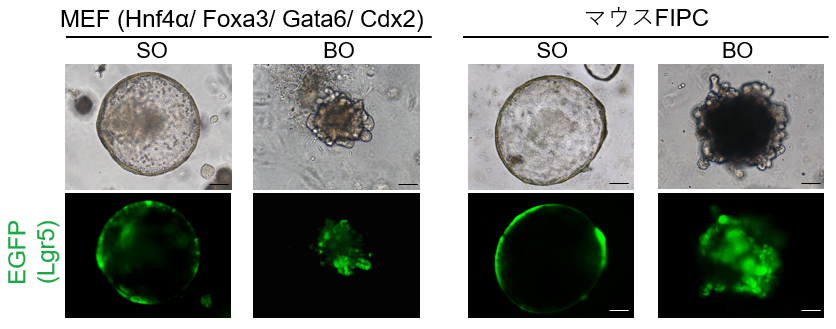
図3. MEFにHnf4α、Foxa3、Gata6、Cdx2を導入することでマウスFIPCと同様にLgr5陽性細胞を含むSOやBOが形成される。(参考文献8より引用)
5. iFIPC由来のBOの性状解析
iFIPC由来のBOの特徴を調べるために、ISC由来のBOとの比較解析を行った。免疫染色の結果、iFIPC由来のBOは、ISC由来のBOと同様にE-cadherinやEzrinといった極性マーカーを発現しており、上皮細胞の特徴である極性を有していた。さらに、iFIPC由来のBOは、Villin陽性の吸収上皮細胞、Lysozyme陽性のパネート細胞、Chromogranin A陽性の内分泌細胞やMuc2陽性の杯細胞を含んでいた。また、CLDには、腸の幹細胞や前駆細胞のマーカーであるSox9やEphB2を発現している細胞が観察され、Ki67陽性の増殖している細胞も確認されたことから、iFIPC由来のBOは幹細胞を含んでいる可能性が示唆された(図4)。
つづいて、幹細胞の特徴である自己複製能について調べた。iFIPC由来のCLDを継代し、7日後にCLDの数をカウントした結果、CLDは7日後に6.4~13.2倍増えていた。このことから、iFIPCから形成されるBOには自己複製の可能なISCが含まれていることが示された。
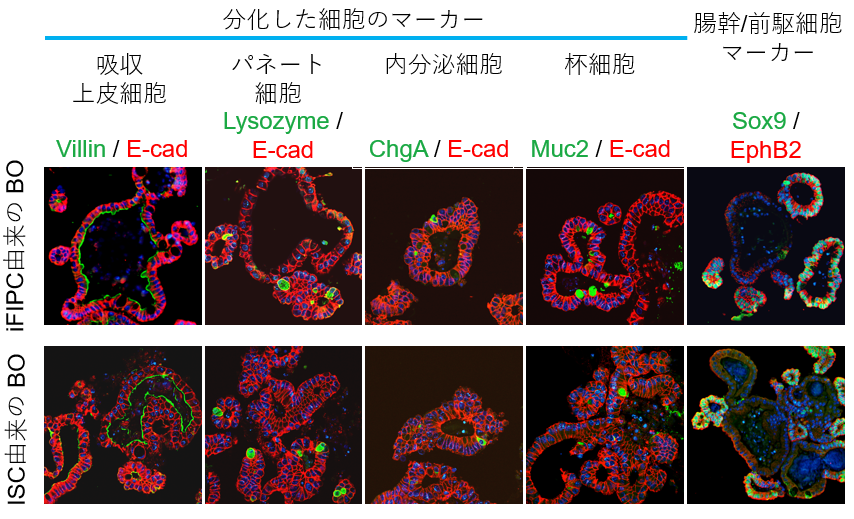
図4. iFIPC由来のBOは、ISC由来のBOと同様に、腸上皮細胞マーカーであるE-cadherinや腸の分化した細胞のマーカーであるVillin(吸収上皮細胞マーカー)、Lysozyme(パネート細胞マーカー)、ChromograninA(ChgA、内分泌細胞マーカー)、Muc2(杯細胞マーカー)、Sox9、EphB2(腸幹/前駆細胞マーカー)を発現している。(参考文献8より引用)
6. iFIPCは障害をうけた大腸組織を再構築できる
FIPCは、障害をうけた大腸に移植すると、大腸組織を再構築できる4)。そこで、iFIPCが大腸組織を再構築できるかどうかを調べた。iFIPC由来のSOを大腸炎モデルマウスに移植し、3か月後に解析を行うと、FIPC由来のSOと同様に、大腸上皮組織を再構築できた。iFIPC由来のSOが生着した腸上皮組織は、VillinやChromogranin A、Muc2といった分化マーカーを発現しており、cryptではSox9やEphB2の腸幹細胞マーカーの発現が見られた(図5)。さらに、iFIPC由来のSOを移植したマウスは、MEFを移植したマウスよりも体重の回復が早く、iFIPCは障害をうけた大腸組織を機能的に再構築できることが示された。
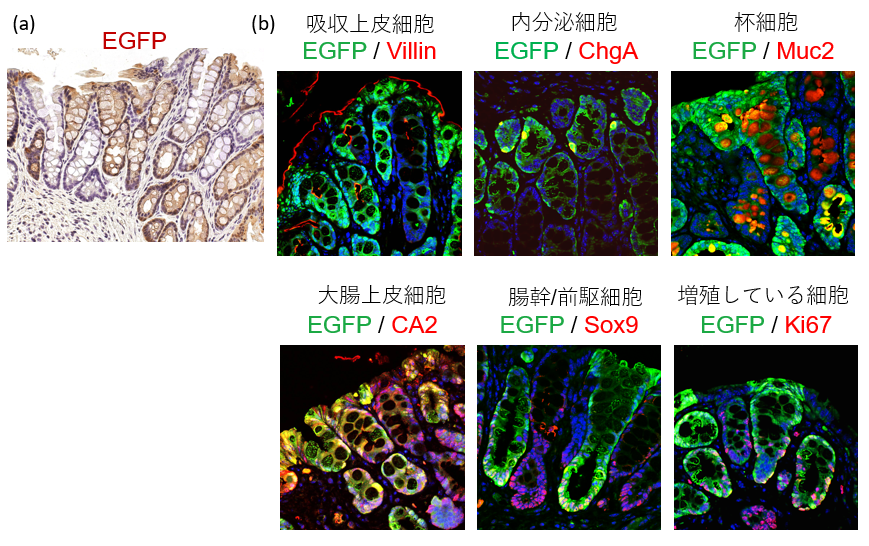
図5. (a) EGFPでマークしたiFIPC由来のSOを大腸炎モデルマウスに移植すると、大腸組織を再構築できる。茶色に染色された部分がEGFP陽性のドナー由来の細胞。
(b)生着した細胞は、吸収上皮細胞、内分泌細胞、杯細胞へと分化可能であり、大腸上皮細胞マーカーのCA2を発現している。また、cryptの部分では腸幹/前駆細胞マーカーのSox9や増殖している細胞のマーカーであるKi67を発現している。(参考文献8より引用)
7. ヒトiFIPCの作製
マウスのiFIPCの作製の際に使用した転写因子をヒト臍帯静脈内皮細胞(HUVEC)に導入し、ヒトiFIPCを誘導した。その結果、ヒト胎児腸由来のFIPCと同様にSOを形成し、三次元培養下で少なくとも6か月維持できた(図6)。しかしながら、マウスのFIPCやiFIPCとは異なり、外来性のWnt刺激を除いても両方でBOは形成されなかった。長期間培養を行ったヒトiFIPC由来のSOの性状解析を行うと、ヒトFIPC由来のSOと同様に極性を持ちE-cadherinやKlf5などの腸上皮細胞マーカーを発現する細胞で構成されていた。さらに、ヒトiFIPC由来のSOを大腸炎モデルマウスに移植すると、マウスの大腸組織中でヒト大腸上皮組織を再構築することが可能であった(図7)。
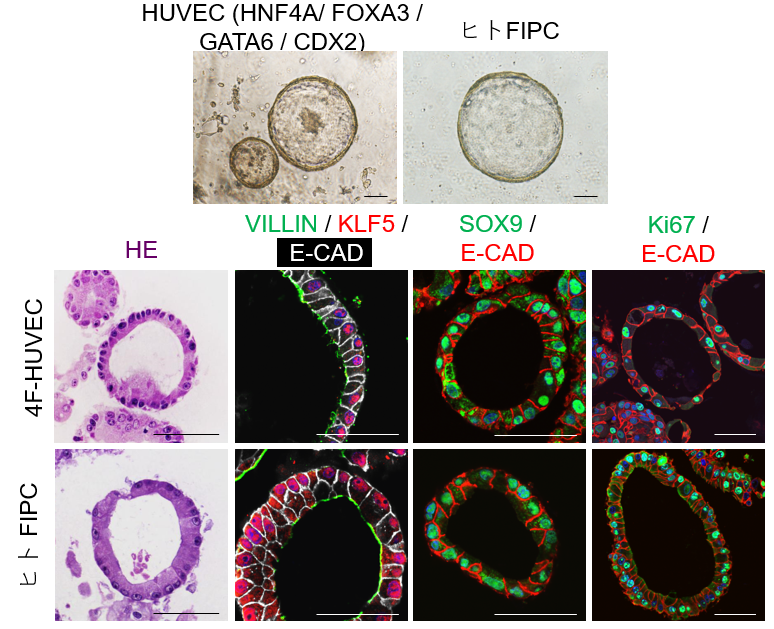
図6. ヒト臍帯静脈内皮細胞(HUVEC)にHNF4A、FOXA3、GATA6、CDX2を導入すると、ヒトFIPCと同様にSOを形成し、腸上皮細胞マーカーを発現する。(参考文献8より引用)
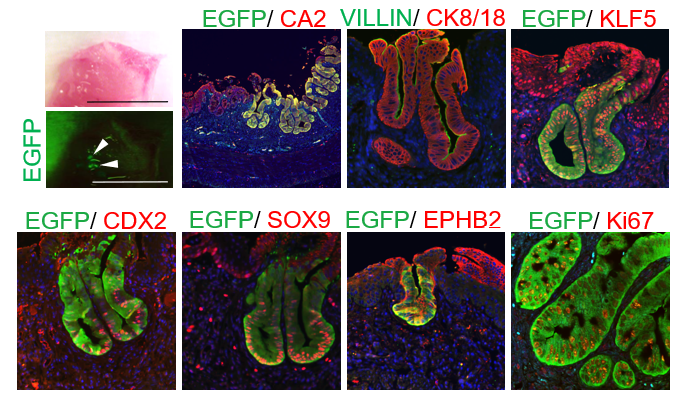
図7. EGFPでマークしたヒトiFPC由来のSOを大腸炎モデルマウスに移植すると、大腸上皮細胞マーカー(CA2)、ヒト細胞特異的CK8/18、腸上皮細胞マーカー(KLF5、CDX2)、腸幹/前駆細胞マーカー(SOX9、EPHB2)、増殖している細胞もマーカー(Ki67)を発現する。(参考文献8より引用)
8. おわりに
本研究では、4つの転写因子を組み合わせて導入することで、MEFとHUVECをiFIPCへと変化させることに成功した。また、マウスの研究においてSOをBOへと分化させることができ、iISCを作製できた。今後は、ヒトのSOからBOへと分化転換させる方法を確立するとともに、成人の皮膚や血液由来の細胞からヒトiFIPCを作製することで創薬研究や移植医療へ応用したい。
参考文献
- Baker N., van Es J.H., Kuipers J., et al. Identification of stem cells in small intestine and colon by marker gene Lgr5. Nature, 449, 1003-1007 (2007).
- Sato T., Vries R.G., Snippert H.J., et al. Single Lgr5 stem cells build crypt- villus structures in vitro without a mesenchymal niche. Nature, 459, 262-265 (2009).
- Fukuda M., Mizutani T., Mochizuki W., et al. Small intestinal stem cell identity is maintained with functional Paneth cells in heterotopically grafted epithelium onto the colon. Genes Dev, 28, 1753-1757 (2014).
- Fordham R.P., Yui S., Hannan N.R., et al. Transplantation of expanded fetal intestinal progenitors contributes to colon regeneration after injury. Cell Stem Cell, 13,734-744 (2013).
- Spence J.R., Mayhew C.N., Rankin S.A., et al. Directed differentiation of human pluripotent stem cells into intestinal tissue in vitro. Nature, 470, 105-109 (2011).
- Sekiya S. and Suzuki A. Direct conversion of mouse fibroblasts to hepatocyte-like cells by defined factors. Nature, 475, 390-393 (2011).
- Inada H., Udono M., Matsuda-Ito K., et al. Direct reprogramming of human umbilical vein- and peripheral blood-derived endothelial cells into hepatic progenitor cells. Nat Commun, 11, 5292 (2020).
- Miura S. and Suzuki A. Generation of mouse and human organoid-forming intestinal progenitor cells by direct lineage reprogramming. Cell Stem Cell, 21, 456-471 (2017).
Profile
関連製品
- Afamin/Wnt3a CM
無血清培地における安定的なオルガノイド培養の実現に。 - Afamin/Wnt3a CM 無償サンプル申請フォーム

