蛍光タンパク Fluoppi
一般的なご質問
-
punctaの観察に必要な機器、および推奨の仕様について教えてください。
-
Fluoppiシステムがワークした細胞について実績を教えてください。
-
Fluoppiシステムは、浮遊細胞に適用できますか?
-
細胞を固定して観察できますか?
-
Fluoppiシステムは細胞に対して毒性がありますか?
-
無細胞発現系で実施可能ですか?
-
Fluoppiシステムでホモダイマーを検出できますか?
-
Fluoppiシステムは、膜タンパク質のPPI解析に適用できますか?
-
Azami-GreenおよびAshタグを融合したタンパク質が本来の細胞内局在を反映しない可能性はありますか?
-
発現量の最適化の方法は?
-
ライセンス確認書はどのような時に必要ですか?
-
発現を確認したいのですが、抗体はありますか?
スクリーニングに関するご質問
一般的なご質問-ご回答
- punctaの観察に必要な機器、および推奨の仕様について教えてください。
フィルター/レーザーについて
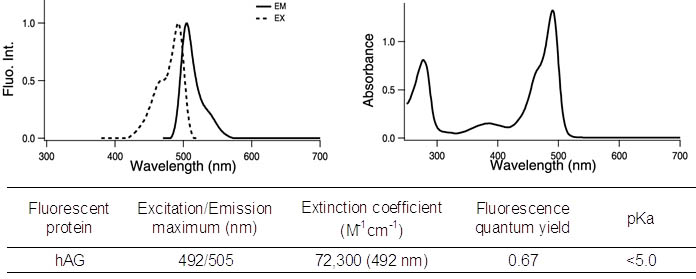
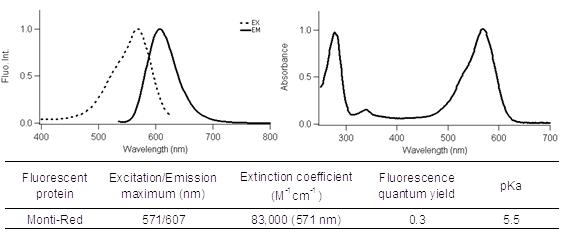
Azami-GreenとMonti-Redの励起波長と蛍光波長はそれぞれ以下のとおりです。
Azami-Green:励起波長 492 nm、蛍光波長 505 nm
Monti-Red:励起波長 571 nm、蛍光波長 607 nm
フィルターの例:Azami Green; BP460-480HQ, DM485, BA495-540HQ (U-MGFPHQ, Olympus)
Monti-Red; 550DF30, 590DRLP, 610ALP (Omega optical)
Azami-Greenは488 nm、Monti-Redは561 nmのレーザーで励起することができます。
対物レンズについて
punctaを検出観察するためには、X10やX20など、開口数(N.A.)が比較的小さな対物レンズを使用することをおすすめします。punctaは細胞内で上下に分布しているため、高いN.A.の対物レンズでは一度の撮影で全てのpunctaに焦点を合わせる事が難しくなります。N.A.が大きな対物レンズを使用する場合、共焦点顕微鏡システムなどを使用することをおすすめします。
Azami Green
Monti-Red
- Fluoppiシステムがワークした細胞について実績を教えてください。
HeLa, HEK293, HEK293T,COS-7, U2OS, A549, A431などの細胞株です。
相互作用検出にタグ以外の構成要素は必要ないため、原理的にはどのような細胞でも実施可能です。 - Fluoppiシステムは、浮遊細胞に適用できますか?
浮遊細胞でのデータは取得しておりません。 - 細胞を固定して観察できますか?
FRETやBRETとは異なり、4%-Paraformaldehyde (PFA)での固定が可能です。
特に、薬剤のハイスループットスクリーニングを行う際には、細胞を固定することで反応時間が一定となり、ウェルやプレート間における実験条件の差を抑えることができます。 - Fluoppiシステムは細胞に対して毒性がありますか?
これまでのところ、複数種の安定細胞株を構築した実績があるため、Fluoppiシステムが細胞株の生存に影響を与えるとは考えておりません。
一方で、標的タンパク質による細胞毒性が想定される場合には、相互作用するドメイン部分のみをアッセイに用いるなどの対処法が考えられます。 - 無細胞発現系で実施可能ですか?
これまでのところ実施例はありません。 - Fluoppiシステムでホモダイマーを検出できますか?
Ash-tagを利用したホモダイマー検出系の開発についての文献報告を行っております。(製品未発売)Watanabe T. et al., Genetic visualization of protein interactions harnessing liquid phase transitions. Sci Rep. 7, Article number: 46380 (2017) PMID: 28406179
- Fluoppiシステムは、膜タンパク質のPPI解析に適用できますか?
Fluoppiシステムは、形質膜貫通タンパク質に適用することはできません。しかし、形質膜アンカータンパク質であるRalBとSec5間のPPIを観察した実績があります。 - Azami-GreenおよびAshタグを融合したタンパク質が本来の細胞内局在を反映しない可能性はありますか?
Fluoppiシステムの原理上、検出対象のタンパク質によっては、本来の細胞内局在と異なるケースもあります。
しかし、弊社におけるRalB-Sec5, およびCDK-4-CyclinD1-p21などの検討では、それぞれ細胞膜および核質内にpunctaが確認され、本来の局在を反映する結果が得られました。 - 発現量の最適化の方法は?
安定発現株を使用する場合には、観察に適した標的タンパク質の発現量のクローンを選択してアッセイに用いることをお勧めいたします。
一過性発現の場合には、トランスフェクション条件、(試薬、プラスミドの量、および2つのプラスミドの比率など)を最適化して発現量を調整してください。 - ライセンス確認書はどのような時に必要ですか?
非営利機関にご所属で非営利研究目的に使用される場合、ライセンス確認書に同意のうえ、署名を頂く必要があります。
>> 詳細はこちらをご確認ください。
営利機関、非営利機関を問わず、営利目的・商用目的でご使用される場合は、購入時にライセンス契約が必要となります。
>> 詳細についてはお問い合わせください。 - 発現を確認したいのですが、抗体はありますか?
こちらをご覧ください。
>> Azami-Green 検出抗体一覧
>> 抗Ashタグ抗体
スクリーニングに関するご質問-ご回答
- 実績のあるハイコンテントスクリーニング機器について教えてください。
・GE Healthcare UK Ltd. 「IN Cell Analyzer 1000/2200/6000」
・Molecular Devices, Inc. 「ImageXpress」
・PerkinElmer, Inc. 「Operetta™/Opera Phenix™」
・Thermo Fisher Scientific, Inc. 「ArrayScan™」
・横河電機株式会社 「Cell Voyager™ CV1000/CV7000」 - punctaの定量化の方法について教えてください。
弊社では、画像解析ソフトにより、punctaの領域を認識させ、その中の蛍光輝度を測定します。一度に多数の細胞を解析する場合は、解析対象全体のpunctaの蛍光輝度を核の数で割ります。
>> 解析例はこちらを参照してください。(PDF)



