タグとタグ抗体
タグとは?
目的タンパク質の機能・局在あるいは立体構造などを調べるために、生体内にある多種類のタンパク質の中から抗体を使って目的のタンパク質の局在や発現量を調べたり、精製することが必要となります。しかし、必ずしも目的タンパク質に対する特異抗体が手に入るとは限りません。そこで、遺伝子工学的手法により、目的のタンパク質に目印(タグをつけて生体内に発現させることで、他の類似のタンパク質と区別することができます。

※FLAG®はSigma-Aldrich Co. LLC.の登録商標です。
タグの種類
タグには様々な種類があり、目的によって使い分けられます。
ペプチドタグ
| タグ | 由来 | サイズ (ペプチド配列) | 特徴 |
|---|---|---|---|
| DDDDK(FLAG®) | 人工配列 | 8アミノ酸(1.0 kDa) (DYKDDDDKなど) |
FLAG®(SIGMA)としてとても有名なペプチドタグ。 |
| HA | ウイルス | 9アミノ酸(1.1 kDa) (YPYDVPDYA) |
インフルエンザの表面に存在する糖タンパク質であるヘマグルチニンから、抗体の認識部位として決定された。(Wilson IA et al. PMID: 6204768 ) |
| 6×His | 人工配列 | 6アミノ酸(0.8 kDa) (HHHHHH) |
ニッケルカラムなどの金属キレートカラムを用いたタンパク質精製が可能であり、安価に大量に精製したい時におすすめ。ニッケルカラムの場合、尿素やグアニジン塩酸塩で変性させたタンパク質の精製も可能。 |
| Myc | ヒトc-Mycタンパク質 | 10アミノ酸(1.2 kDa) (EQKLISEEDL) |
c-Mycタンパク質は細胞周期やアポトーシスに関与する転写因子で、c-Mycの変異や過剰発現などの異常は様々な造血系のがんに関与している。 |
| V5 | ウイルス | 14アミノ酸(1.4 kDa) (GKPIPNPLLGLDST) |
パラミクソウイルス科ルブラウイルス属SV5(Simian virus 5)のPタンパク、Vタンパクに存在している。 |
| S | ヒト膵臓 RNase A |
15アミノ酸(1.7 kDa)(KETAAAKFERQHMDS) | S-tagはSタンパクと強く結合し、RNase Sとして機能する。この性質を利用し、酵素活性を用いた検出や定量分析が可能。 |
| E | オステオカルシン断片 | 13アミノ酸(1.4 kDa)(GAPVPYPDPLEPR) | 骨芽細胞が産生する骨ホルモンのオステオカルシン由来のペプチド配列。 |
| T7 | ウイルス | 11アミノ酸(1.2 kDa)(MASMTGGQQMG) | T7ファージ キャプシドタンパク質のN末端ペプチド。 |
| VSV-G | ウイルス | 11アミノ酸(1.3 kDa)(YTDIEMNRLGK) | Vesicular stomatitis virus G glycoproteinの略。ウイルスのエンベロープに含まれる配列。 |
| Glu-Glu | ウイルス | 9アミノ酸(1.2 kDa)(EEEEYMPME) | ポリオーマウイルス中型T抗原に含まれる配列。 |
| Strep-tag II | 人工配列 | 8アミノ酸(1.1 kDa)(WSHPQFEK) | ストレプトアビジンのビオチン結合部位へ結合能を持つペプチド配列。ストレプトアビジンとビオチンの結合性を利用したタンパク質精製システムも構築されている。 |
| HSV | ウイルス | 11アミノ酸(1.2 kDa)(QPELAPEDPED) | ヘルペスウイルス(herpes simplex virus)のエンベロープに含まれるペプチド配列。 |
| CBD(Chitin Binding Domain) | 大腸菌 | 29アミノ酸(3.1 kDa)(TTNPGVSAWQVNT AYTAGQLVIYNGKTYK) |
精製したい目的タンパク質にインテインとキチン結合ドメイン(CBD)を融合させ、インテインによる自己切断を引き起こすことで、目的タンパク質のみを精製する方法としてよく用いられる。 |
| CBP(Calmodulin Binding Peptide) | ウサギ | 26アミノ酸(3.0 kDa)(KRRWKKNFIAVSAA NRFKKISSSGAL) |
カルモジュリン結合ペプチド(CBP)はカルシウム存在下でカルモジュリンと強結合するため、カルモジュリンを用いたアフィニティー精製時には強い洗浄条件が可能となり、非特異吸着を抑制できる。さらに大腸菌にはカルモジュリンと相互作用するタンパク質は存在しないため、純度の高いタンパク質を精製可能。 |
ポリペプチドタグ
発現させるタンパク質の可溶性が高くなり、大腸菌で発現させる場合、不溶化しやすいタンパク質を可溶化タンパク質として発現させ易くなる。
| タグ | 由来 | サイズ | 特徴 |
|---|---|---|---|
| GST(Glutathione-S-transferase) | 寄生虫 (日本住血吸虫 :Schistosoma japonicum) |
26 kDa | GSTの基質であるグルタチオンとの親和性を利用したアフィニティ精製が可能。ただし分子量が大きく、タンパク質の構造・機能を阻害する可能性があるため、精製後にタグを切断することが好ましい。 |
| MBP(Maltose Binding Protein) | 大腸菌 | 43 kDa | アミロース結合カラムを用いた精製が可能。マルトースとの親和性を利用し、カラムに捕捉されたMBP融合タンパク質を溶出する。 |
| Thioredoxin(Trx) | 大腸菌 | 12 kDa | チオレドキシンは生体内の様々な酸化還元反応に関与する酵素。ヒトのサイトカインや増殖因子を大腸菌で発現させると不溶性画分に凝集してしまうことが多いが、チオレドキシン融合タンパク質では可溶性が高くなるため、活性を保ったまま精製可能になる。 |
AIDシステムに使用するタグ
植物ホルモンを利用したタンパク質発現制御技術「AIDシステム」に使用するタグ。動物細胞内で発現させたタンパク質の速やかな分解に利用される。
| タグ | 由来 | サイズ | 特徴 |
|---|---|---|---|
| mini-AID | 植物ホルモン | 全長AID-tag(IAA17)229アミノ酸、およびmini-AID tag 68アミノ酸 | 細胞内に発現させたターゲットタンパク質を、植物ホルモンとして知られるオーキシンの添加により速やかに分解できる実験系として確立された、AIDシステムに用いるタグ(Nishimura K et al. PMID: 19915560)。 |
レポーター遺伝子
目的の遺伝子が発現しているか確認するためのマーカー遺伝子。
◆ルシフェラーゼ(発光酵素)
| タグ | 由来 | サイズ | 特徴 |
|---|---|---|---|
| Luciferase | ホタル | 61 kDa | ホタルから単離された発光酵素。発光基質ルシフェリンがATPとマグネシウムイオン存在下で酵素と反応することで発光が起こる。黄緑色(最大発光波長562 nm)の光を生じる。遺伝子のプロモーター/エンハンサー領域の転写活性の解析を調べるため、レポーター遺伝子としてルシフェラーゼがよく用いられている。 |
| Renilla Luciferase | ウミシイタケ | 36 kDa | 酵素とカルシウムイオンと結合して活性化すると、発光基質ウミシイタケルシフェリンの酸化を触媒する。青緑色(最大発光波長562 nm)の光を生じる。 |
◆蛍光タンパク質
| タグ | 由来 | サイズ | 特徴 |
|---|---|---|---|
| GFP | クラゲ | 27 kDa | GFP融合タンパク質を発現させて、蛍光での検出が可能。さらに感度を高めたい場合や、ホルマリン固定組織染色やWBなどの、蛍光を発しなくなったサンプルを検出する場合に抗GFP抗体を用いる。 |
| Renilla GFP | ウミシイタケ | 26 kDa | Renilla GFPの明るさはEGFPと同等だが、退色しにくい。また、EGFPと比べて細胞毒性が低い。 |
| RFP | サンゴ由来DsRedのバリアント | 27 kDa | サンゴ(Discosoma sp.)から単離された蛍光タンパク質であるDsRedを改変して作られた蛍光タンパク質。DsRedは4量体を形成しているが、単量体で蛍光を発するバリアントが多く作製されている。 |
◆その他
| タグ | 由来 | サイズ | 特徴 |
|---|---|---|---|
| β-galactosidase | 大腸菌 | 116 kDa | β-ガラクトシダーゼは大腸菌のLacZ遺伝子がコードするタンパク質で、ラクトースをグルコースに分解して解糖系でエネルギーを得るために必要な酵素。遺伝子工学の分野ではその存在を確認するため、X-Galを基質とした呈色反応を利用することで有名である。 |
ハプテン
| タグ | 由来 | サイズ | 特徴 |
|---|---|---|---|
| Digoxigenin(DIG) | 植物由来ステロイド | 390 Da | DIGはハプテンでタンパクや核酸にコンジュゲートしやすく、ビオチンやFluoresceinと同様にバイオ分野で様々なアプリケーションに用いられている。特に核酸UTPにコンジュゲートしたDIGはプローブにラベルできるため、DIG抗体と共に用いることで非RI標識でのNorthern Blotting、Southern Blotting、ISHを可能にした。 |
| FITC | 小分子の蛍光色素 | 390 Da | FITC(Fluorescein isothiocyanate)は単なる蛍光色素としてではなく、ビオチンやDIGと同様にタンパク質や核酸プローブなどのラベルとして用いられる。FITCラベルしたタンパク質や核酸は直接観察することもできるが、退色しやすいため、抗FITC抗体と標識2次抗体を用いることで高感度に検出することが可能となる。 |
タグ抗体の使い方
| 方法 | 目的 | |
|---|---|---|
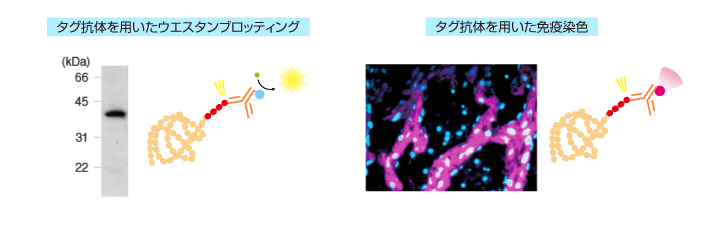
| 検出 | ・ウエスタンブロッティング ・免疫沈降(IP)、共免疫沈降(Co-IP) ・免疫染色(IC、IH) ・フローサイトメトリー(FCM) |
・発現の有無確認 ・タグ融合タンパク質に結合する因子の解析(Co-IP) ・細胞内における局在 |
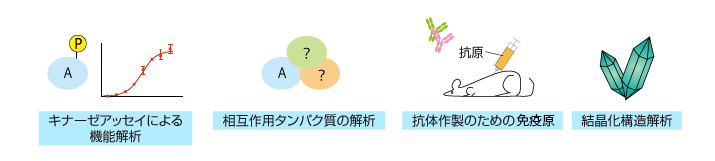
| 精製 | ・抗原抗体反応を利用した精製 | ・相互作用タンパク質の解析(プルダウンアッセイ) ・結晶(化)構造解析 ・抗体作製のための免疫原 ・キナーゼアッセイ |
検出方法
精製タンパク質の使用目的
タグ・タグ抗体を用いる場合の長所と短所
| 長所 | タグ配列は動物細胞由来でない配列であることが多いため、タグ抗体は非特異反応が少なく、反応性が高いものが多い。 |
|---|---|
| 目的タンパク質に対する良い抗体がない場合、タグ融合タンパク質として細胞内に発現させ、その挙動を観察することができる。 | |
一種類のタグ抗体で、同じタグが付いた複数のタンパク質を検出・精製することができる。 |
|
タグ融合タンパク質を精製後、特定のプロテアーゼでタグのみを除去できるものもある。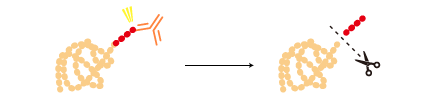 |
|
2つのタグを融合させて2段階に精製することで純度を高めることができる。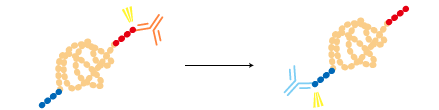 |
|
| 共免疫沈降を行う際、目的タンパク質特異的抗体を用いた場合、その抗体が他のタンパク質との結合を阻害する可能性があるが、タグ・タグ抗体を用いることで回避することができる。 | |
| タグを付加することにより、不溶化タンパク質を可溶化できる場合がある。 | |
| 蛍光タンパク質をタグとして用いた場合、生きた細胞内のタンパク質局在を見ることができる。 | |
| 短所 | 発現させたタグ融合タンパク質は人工物であり、実際の生体内での反応を模倣できていない可能性がある。 |
| タグを融合する位置によっては(N末、C末など)タンパク質の構造に影響を与え、活性を失う可能性がある。 | |
| 複数のタグ融合タンパク質を一つの実験系で用いる場合、タグの種類が重複しないような工夫が必要。 | |



